цвета каления — это… Что такое цвета каления?
- цвета каления
- цвета́ кале́ния
-
цвета свечения металла, зависящие от температуры нагрева. Для железа и стали характерны следующие цвета каления (см. табл.). До появления пирометров по цветам каления определяли температуру термической (закалка, отпуск), химико-термической (цементация, цианирование) и термомеханической обработки стали.
Цвета каления железа и стали
Энциклопедия «Техника». — М.: Росмэн. 2006.
.
- Цандер
- цвета побежалости
Смотреть что такое «цвета каления» в других словарях:
ЦВЕТА КАЛЕНИЯ
 Цвета каления, характерные для стали, смотри в таблице Температуpa, ° С Цвет каления 550 Темно коричневый 630 Коричнево красный 680 Темно красный 740 Темно вишневый 770 Вишневый 800… … Металлургический словарь
Цвета каления, характерные для стали, смотри в таблице Температуpa, ° С Цвет каления 550 Темно коричневый 630 Коричнево красный 680 Темно красный 740 Темно вишневый 770 Вишневый 800… … Металлургический словарьцвета каления — цвета свечения металла, нагретого до высоких температур (например, для стали от тёмно коричневого при 550°C до белого при 1300°C). * * * ЦВЕТА КАЛЕНИЯ ЦВЕТА КАЛЕНИЯ, цвета свечения металла, нагретого до высоких температур (напр., для стали от… … Энциклопедический словарь
ЦВЕТА КАЛЕНИЯ — цвета свечения металла, нагретого до высоких температур (напр., для стали от темно коричневого при 550 .С до белого при 1300 .С) … Большой Энциклопедический словарь
Цвета каления — О фильме см. Белое каление (фильм) Цвета каления это цвета свечения металла, раскалённого до высокой температуры. Спектр … Википедия
цвета каления — [heat colors] цвета свечения металла (сплава), зависящий от температуры его нагрева.
 Некоторые цвета каления, характерные для углеродной стали: темно коричневый (550 °С), темно красный (680 °С), вишневый (770 °С), яркокрасный (900 °С), желтый… … Энциклопедический словарь по металлургии
Некоторые цвета каления, характерные для углеродной стали: темно коричневый (550 °С), темно красный (680 °С), вишневый (770 °С), яркокрасный (900 °С), желтый… … Энциклопедический словарь по металлургииЦвета каления — цвета свечения металла (сплава), зависящие от температуры его нагрева. Некоторые Ц. к., характерные для углеродистой стали: тёмно коричневый (550 °С), тёмно красный (680 °С), вишнёвый (770 °С), ярко красный (900 °С), жёлтый (1000 °С),… … Большая советская энциклопедия
ЦВЕТА КАЛЕНИЯ — цвета свечения металла, зависящие от темп ры нагрева. Для стали характерны след. Ц. к.: Темп ра, °С Цвет Темп ра. °С Цвет 550 Темно коричневый 850 … Большой энциклопедический политехнический словарь
Цвета побежалости — на кристалле висмута … Википедия
цвета побежалости стали — [annealing (temper) colors] 1. Радужная окраска, появляющаяся на чистой поверхности нагретой стали в результате образования на ней тончайшей оксидной пленки.
 Толщина пленки зависит от температуры нагрева; пленки разной толщины по разному отражают … Энциклопедический словарь по металлургии
Толщина пленки зависит от температуры нагрева; пленки разной толщины по разному отражают … Энциклопедический словарь по металлургииЦвета — [colors]: Смотри также: цвета побежалости стали цвета каления … Энциклопедический словарь по металлургии
Температура и цвета каления металлов
Испускаемый раскаленными металлами свет имеет при каждой температуре особый оттенок (цвета каления). Температуры, соответствующие различной интенсивности свечения накаленного железа, приблизительно таковы [c.312]Высокую температуру также можно приблизительно определять по цветам каления металлов (табл. 6). [c.27]
Температура нагрева металла при ручной ковке обычно определяется по цветам каления. Более точно определяют температуру нагрева при помощи оптических илн термоэлектрических пирометров. [c.592]
Физические свойства металлов платиновой группы сходны между собой (табл.
 4). Это—очень тугоплавкие труднолетучие металлы светло-серого цвета разных оттенков. По удельным весам платиновые металлы разделяются на легкие (рутений, родий, палладий) и тяжелые (оомий, иридий, платина). Температура плавления и кипения убывает слева направо в обеих триадах (от рутения до палладия и от осмия до платины) и воз-)астает снизу вверх по вертикали в периодической системе. -1аиболее тугоплавки осмий и рутений, самый легкоплавкий — палладий. При высоких температурах наблюдается улетучивание платины, иридия, осмия и рутения. Рутений постепенно улетучивается при сильном прокаливании на воздухе вследствие образования летучей четырехокиси. Иридий теряет в весе при температуре около 2000° С. Осмий легко сгорает на воздухе, образуя летучий окисел 0б04. Осмий, рутений и родий очень тверды и хрупки. Платина и палладий (ковкие металлы) поддаются прокатке п волочению. Иридий поддается механической обработке лишь при температуре красного каления.
4). Это—очень тугоплавкие труднолетучие металлы светло-серого цвета разных оттенков. По удельным весам платиновые металлы разделяются на легкие (рутений, родий, палладий) и тяжелые (оомий, иридий, платина). Температура плавления и кипения убывает слева направо в обеих триадах (от рутения до палладия и от осмия до платины) и воз-)астает снизу вверх по вертикали в периодической системе. -1аиболее тугоплавки осмий и рутений, самый легкоплавкий — палладий. При высоких температурах наблюдается улетучивание платины, иридия, осмия и рутения. Рутений постепенно улетучивается при сильном прокаливании на воздухе вследствие образования летучей четырехокиси. Иридий теряет в весе при температуре около 2000° С. Осмий легко сгорает на воздухе, образуя летучий окисел 0б04. Осмий, рутений и родий очень тверды и хрупки. Платина и палладий (ковкие металлы) поддаются прокатке п волочению. Иридий поддается механической обработке лишь при температуре красного каления. Платина — наиболее важный из палладиевых и платиновых металлов. Она обладает серовато-белым цветом и очень хорошо поддается ковке. При температуре красного каления ее можно сваривать, а в водородно-кислородном пламени — плавить. Вследствие очень малой химической активности ее применяют при производстве электрической аппаратуры и используют в качестве материала для изготовления тиглей и другого лабораторного оборудования. На платину действует хлор она растворяется в царской водке. Платина взаимодействует с расплавленными щелочами, такими, как гидроокись калия, но не взаимодействует с карбонатами щелочных металлов.
[c.556]
Она обладает серовато-белым цветом и очень хорошо поддается ковке. При температуре красного каления ее можно сваривать, а в водородно-кислородном пламени — плавить. Вследствие очень малой химической активности ее применяют при производстве электрической аппаратуры и используют в качестве материала для изготовления тиглей и другого лабораторного оборудования. На платину действует хлор она растворяется в царской водке. Платина взаимодействует с расплавленными щелочами, такими, как гидроокись калия, но не взаимодействует с карбонатами щелочных металлов.
[c.556]
Фтористый водород и плавиковая кислота быстро действуют на молибден, переводя его во фториды. Серная разбавленная кислота (б =1,3) слабо действует на молибден даже при 110°. Концентрированная серная кислота ( =1,82) на холоду действует слабо за 18 ч потеря в весе 0,24%. При 200—250 растворение идет быстрее. Фосфорная и органические кислоты воздействуют на металл слабо, но в присутствии окислителей, включая воздух, растворимость заметно увеличивается.
Свойства простого вещества и соединений. Германий обладает серебристо-белым цветом и по внешнему виду похож на металл. Свою неметаллическую суть выдает изменением электрической проводимости при нагревании (рис. 76). В отличие от металлов его проводимость растет с повышением температуры. На воздухе компактный германий не изменяется.
Металлическая сурьма имеет белый цвет и сильный блеск, сохраняющийся на воздухе без изменения, потому что она при обыкновенной температуре не окисляется. Она кристаллизуется ромбоэдрами и имеет весьма явственно кристаллическое сложение, которое придает ей совсем иной вид, чем у большинства до сих пор знакомых нам металлов. Сурьма хрупка, так что легко превращается в порошок уд. вес ее = 6,7 она плавится при 629″,5. но улетучивается только при температуре яркокрасного каления. Накаленная на воздухе, напр., пред паяльною трубкою, она загорается, и дает белые пары, не имеющие запаха и состоящие из Sb 0 . Этот окисел носит обыкновенно название окиси сурьмы, хотя его с таким же правом можно назвать и сурьмянистым ангидридом.
Металлический бериллий отличается серо-стальным цветом и значительной твердостью, так что царапает стекло. При обычной температуре он ломок и не выдерживает ковки. Однако при температуре красного каления Ве становится ковким. Электропроводность бериллия равна около 1/12 электропроводности меди . В сухой атмосфере он сохраняет блестящую поверхность. При соприкосновении с водой Ве покрывается тонкой пленкой окисла, которая и предохраняет его от дальнейшей коррозии разбавленные кислоты энергично его растворяют. Концентрированная азотная кислота на холоду не оказывает на него заметного действия, а реакция его с разбавленной (2 н.) азотной кислотой на холоду вскоре прекращается. При нагревании эти кислоты быстро его растворяют. От остальных металлов главной подгруппы II группы бериллий резко отличается своей растворимостью в водных растворах щелочей.
Тетрафторид титана легко получается при комнатной температуре в результате взаимодействия фтористого водорода с тетрахлоридом титана [177, 181]. При этой реакции получается промежуточный продукт желтого цвета, содержащий как фтор, так и хлор. Подобный же продукт образуется при сплавлении тетрахлорида титана с фторидом серебра. Безводный тетрафторид образуется также при реакции между титаном и фтором или фтористым водородом. Первая из этих реакций может быть инициирована легким пагреванием металла, в то время как вторая происходит только при температуре красного каления.
При индукционном нагреве можно паять все токопроводящие металлы, проводники (например, графит), металлизированную керамику. Для контроля температуры применяют пирометр (ФП-3 для сталей). Фотоэлектрические пирометры реагируют на цвет каления нагретого металла и поэтому пригодны для контроля температуры выше 750 °С. [c.235]
Окисление щелочных металлов серой идет также очень энергично при растирании металла с серным цветом происходит взрыв. Азотом и углеродом окисляется только литий при высокой температуре, примерно в пределах 580—640° С (красное каление). Реакция протекает очень энергично, и при этом выделяется тепло 207,5 кдж/моль [c.234]
При укладке образцов на обжиг нужно предусматривать доступ воздуха ко всей поверхности металла, что обеспечивается размещением образцов на специальной подставке. Обжиг считается законченным, когда пластинки приобретают цвет красного каления печи в интервале 650—850° С. После обжига образцы должны остыть на подставке. Признаком хорошего обжига является хорошо отстающая окалина красно-шоколадного цвета. Образцы тщательно очищают от окалины и подвергают травлению при комнатной температуре в 20%-ном растворе НС1. [c.259]
Металлический бериллий получают восстановлением его фторида магнием. Металл блестящего серебристо-белого цвета, плавится при температуре 1300° при нагревании па воздухе поверхность покрывается окисью. Тонкий порошок при нагревании горит, образуя окись, легко растворим в кислотах, но не разлагает воду даже при красном калении. Компактный металл не реагирует с холодной разбавленной серной или концентрированной азотной кислотами, только медленно растворяется при нагревании. Уд. вес 1,82. [c.61]
Металл блестящего серебристо-белого цвета, плавится при температуре 1300° при нагревании па воздухе поверхность покрывается окисью. Тонкий порошок при нагревании горит, образуя окись, легко растворим в кислотах, но не разлагает воду даже при красном калении. Компактный металл не реагирует с холодной разбавленной серной или концентрированной азотной кислотами, только медленно растворяется при нагревании. Уд. вес 1,82. [c.61]
Силицид лития LieSi2 образуется в виде мелких блестящих очень гигроскопичных кристаллов темно-синего цвета при нагревании кремния с избытком лития и с последующей отгонкой избытка лития в вакууме при 500°. При нагревании в вакууме до 600° разлагается на литий и кремний. При слабом нагревании на воздухе, в хлоре или фторе воспламеняется. С парами брома и иода взаимодействует при температуре красного каления. С расплавленной серой образует сульфид или полисульфид лития. Силицид лития — сильный восстановитель при температуре красного каления восстанавливает окислы алюминия, марганца и железа до металлов бурно реагирует с водой, с HNO3 — со взрывом [3]. [c.28]
[c.28]
Металлический галлий может быть получен электролизом растворов галлата натрия. Металл сравнительно мягкий и хрупкий, синевато-серого цвета с зеленовато-синим блеском. Плавится при температуре 29,8 и имеет склонность оставаться в переохлажденном состоянии. Галлий даже при темно-красном калении окисляется на воздухе только с поверхности медленно растворяется в минеральных кислотах, но легко растворим в царской водке. Подобно ртути, его можно очистить от следов многих других элементов встряхиванием с теплой разбавленной азотной кислотой. Легко растворяется в едких щелочах с выделением водорода. [c.95]
Гексабориды РЗЭ напоминают бориды щелочноземельных металлов. У 7них высокая твердость, они очень стабильны, окрашены обычно в синий или черный цвет. Микротвердость спеченных УВ , ЬаВе и СеВе соответственно 3264, 2770 и 3140 кг/мм . У них высокая температура плавления, в частности у УВд 2300 . Бориды РЗЭ химически стой-, ки разбавленные кислоты при комнатной температуре на них не действуют, концентрированная НМОз разъедает на холоду, Н2804 — при нагревании. Щелочи реагируют при температуре красного каления. Кислород слабо реагирует с боридами, углерод и азот на них не действуют. [c.76]
Бориды РЗЭ химически стой-, ки разбавленные кислоты при комнатной температуре на них не действуют, концентрированная НМОз разъедает на холоду, Н2804 — при нагревании. Щелочи реагируют при температуре красного каления. Кислород слабо реагирует с боридами, углерод и азот на них не действуют. [c.76]
Общая характеристика. Кобальт — блестящий металл сероп цвета уд. вес 8,9 , темп. пл. 1490° темп. кип. 2900°. Довольн твердый, тугоплавкий. На воздухе устойчив, но измельченны в тонкий порошок быстро окисляется. При температуре белог каления сгорает на воздухе с образованием С03О4. [c.290]
Осаждение редкоземельных элементов в виде оксалатов в кислой среде имеет то преимущество, что, кроме собственно редкоземельных элементов, в этих условиях выпадают еще только оксалаты тория, иттрия и скандия. Оксалаты других металлов в этих условиях остаются в растворе [37]. Потери редкоземельных элементов в кислой среде незначительны однако подкисление раствора позволяет избежать осаждения оксалатов других элементов. Полученные оксалаты редкоземельных элементов промываются разбавленной щавелевой кислотой и прокаливанием переводятся в окислы. Ориентировочно о составе суммы можно судить но цвету полученных окислов. При преобладании в смешанных окислах цериевой группы они окрашены в коричневые тона различной интенсивности, обусловленные присутствием высших окислов празеодима чем больше празеодима (при одинаковых условиях прокаливания), тем гуще коричневая окраска. У чистого высшего окисла празеодима она переходит в черную с коричневым оттенком При обработке смешанных окислов цериевой группы водородом ири температуре светлокрасного каления высший окисел празеодима восстанавливается до РГ2О3, и делается заметной сероголубая окраска окиси неодима. [c.44]
Полученные оксалаты редкоземельных элементов промываются разбавленной щавелевой кислотой и прокаливанием переводятся в окислы. Ориентировочно о составе суммы можно судить но цвету полученных окислов. При преобладании в смешанных окислах цериевой группы они окрашены в коричневые тона различной интенсивности, обусловленные присутствием высших окислов празеодима чем больше празеодима (при одинаковых условиях прокаливания), тем гуще коричневая окраска. У чистого высшего окисла празеодима она переходит в черную с коричневым оттенком При обработке смешанных окислов цериевой группы водородом ири температуре светлокрасного каления высший окисел празеодима восстанавливается до РГ2О3, и делается заметной сероголубая окраска окиси неодима. [c.44]
Карбонилы калия и натрия. Заслуживают рассмотрения реакции, происходящие при взаимодействии окиси углерода с металлами. Так, давно было отмечено, что при действии на калий или натрий при 500—700° окиси углерода происходит воспламенение этих металлов и образуется углерод и окись еоответствующего металла. Если нагревание вести медленно и ниже температуры красного каления, то параллельно с окисью металла обравуется еще вещество темного цвета. [c.282]
Если нагревание вести медленно и ниже температуры красного каления, то параллельно с окисью металла обравуется еще вещество темного цвета. [c.282]
Висмут (свойства см. на стр. 397) — блестящий металл белого цвета с красноватым оттенком (й = 9,80). Он хрупок и поэтому легко измельчается. Висмут имеет такую же кристаллическую решетку, как сурьма и мышьяк, которым он изоморфен (каждый атом решетки имеет три ближайших соседних атома на расстоянии 3,10 Л и три более удаленных соседних атома на расстоянии 3,47 А). Он проводит электрический ток, но хуже, чем истинные металлы (1,4% по отношению к электропроводности серебра). При комнатной температуре висмут не реагирует с кислородом воздуха. При температуре красного каления горит, образуя окись В120з. В тонкоизмельченном состоянии висмут взаимодействует с хлором, как сурьма и мышьяк,— накаливается добела и образует хлорид В1С1з. При нагревании он реагирует также с бромом, иодом и серой. Висмут не растворяется в разбавленных соляной, бромистоводородной и серной кислотах (так же как и сурьма), поскольку имеет более низкий, чем водород, окислительный потенциал (см.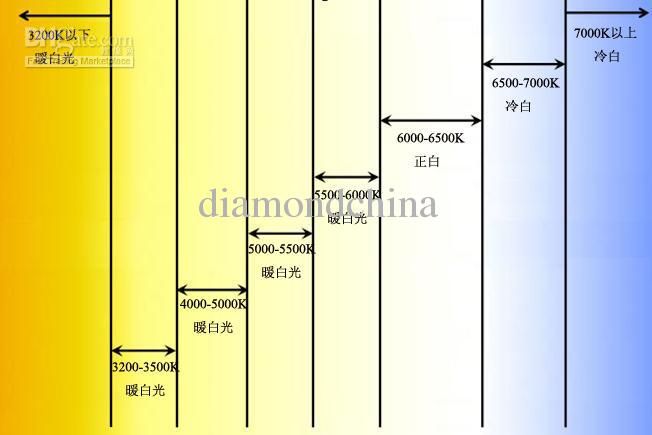 стр. 229). При растворении в концентрированной серной кислоте он окисляется при этом происходит образование ЗОз- [c.454]
стр. 229). При растворении в концентрированной серной кислоте он окисляется при этом происходит образование ЗОз- [c.454]
Комплексные соединения уранилхлорида и галогенидов металлов. Уранилхлорид образует ряд двойных солей типа М2и02С14, где М — одновалентный металл или эквивалентный ион. Безводные К2и02С14 и На2и02С14 получены обработкой галогенида соответствующего щелочного металла парами уранилхлорида при температуре красного каления [66]. Двойные соли представляют твердые вещества золотисто-желтого цвета, растворимые в воде и плавящиеся при температуре красного каления без выделения паров. [c.467]
Физические свойства. Сплавленный совершенно чистый титан сереб-ристо-белый, легкий металл с сильным металлическим блеском, очень твердый, но хорошо поддаюш,ийся вытягиванию в проволоку даже на холоду. Малейшие примеси делают его хрупким на холоду, но сохраняющим ковкость при красном калении (600—700° С) плотность сплавленного титана 4,5. Аморфное видоизменение его — порошок темно-серого, почти черного цвета — обладает способностью адсорбировать водород. 1 г титана поглощает до 400 см водорода при обычной температуре. При этом водород, по-видимому, находится в растворе в атомарном состоянии, так как, выделяясь при нагревании, воспламеняется на воздухе и, сгорая, превращается в воду. [c.293]
Аморфное видоизменение его — порошок темно-серого, почти черного цвета — обладает способностью адсорбировать водород. 1 г титана поглощает до 400 см водорода при обычной температуре. При этом водород, по-видимому, находится в растворе в атомарном состоянии, так как, выделяясь при нагревании, воспламеняется на воздухе и, сгорая, превращается в воду. [c.293]
Вольфрамовые стержни диаметром более 4 мм остекловывать лучше всего на узком пламени кислородной горелки (кварцедувной), разогревая стержень до белого каления. Температура пламени кислородной горелки весьма высокая (свыше 1900°С), поэтому при прогревании окислы вольфрама частично испаряются. Остеклованная поверхность такого металла после охлаждения может иметь прозрачно-красноватый, соломенно-золотистый, серебристый цвет. Во всех этих случаях спай получается хорошего качества. Черный цвет спая вольфрама со стеклом — признак переокисления поверхности металла спай считают непригодным. [c.130]
Предварительную очистку теллура осуществляют перегонкой в токе вс дорода. Для этого металл растирают в агатовой ступке в порошок и поме щают в большую кварцевую лодочку, которую вдвигают в переднюю част кварцевой трубки. Кварцевую лодочку с теллуром постепенно нагревают д красного каления в сравнительно сильном токе чистого сухого водородг При этом теллур плавится и по мере повышения температуры испаряется образуя пары зеленовато-желтого цвета, которые уносятся током водород и конденсируются в более холодной части трубки в виде маленьких метал лических шариков. Перегонку прекращают после испарения приблизительн( [c.466]
С восстановлением металлов из окислов действием углерода можно познакомиться на примерах окислов свинца или олова. Тонкоизмельченный порошок окисла смешивают с древесным углем. Уголь предварительно измельчают в крошку и отсеивают от пыли. В фарфоровый тигель насыпают слой угля, затем смесь угля и окисла металла и сверху снова слой угля в 2—3 см. Затем тигель закрывают крышкой и ставят в тигельную печь. Восстановление ведут 10—12 мин. при температуре 1100° С. Тигельные печи обычно не имеют термопары или термометра для измерения температуры. О температуре в печи можно приближенно судить по цвету нагретого керамического муфеля темно-красное каление — 700° С ярко-красное — 950° С желтое — 1100° С. Через 10—12 мин. тигель осторожно вынимают, захватив его тигельными щипцами. Расплавленный металл можно вылить в фарфоровую чашечку или на керамическую пластинку. Эту операцию целесообразно выполнять без задержки, не давая тиглю охладиться. При охлаждении металл может иногда приплавиться к тиглю и тогда его трудно извлечь, не разбив тигель. Для восстановле- [c.73]
Окиси ниобия(1У) и тантала(1У). ЫЬО., и ТаОо— порошки цвета от темно-серого до черного они нерастворимы в воде и кислотах, но растворяются при окислении в горячей водной щелочи. НЬО, получают нагреванием НЬаОв до белого каления в токе водорода ТаОо образуется при восстановлении ТЗзОа углем при высокой температуре. Двуокиси имеют искаженную решетку рутила, в которой ионы металла в соседних октаэдрах ЛЮд несколько сближены между собой магнитная восприимчивость обоих окислов довольно низкая. Очевидно, в двуокисях, так же как и в дисульфидах МЗ,, существует связь металл —металл 125]. [c.351]
Однако НН40Н является слабым основанием, /(= 10 , и только у замещенных аммониев, например тетраметиламмония, тетраэтил-аммония, гидроокиси являются сильными основаниями, подобными щелочам. Ион при окислении может разрушаться с образованием электронейтрального азота. Важно, что соли аммония легко летучи или разлагаются при нагревании до температуры, близкой к красному калению. Те же соли щелочных металлов и магния в этих условиях нелетучи. Это позволяет отделять соли аммония от солей щелочных металлов и магния прокаливанием сухого остатка солей после выпаривания их раствора. При температуре около 1000°С начинают испаряться соли щелочных металлов. Их пары окрашивают пламя горелки в характерный для каждого металла цвет. [c.172]
Дисилицид железа FeSig темно-серого цвета с сильным блеском. В тонкоизмельченном состоянии он разлагается фтором на холоду, а хлором и бромом — при красном калении. В кислороде это соединение окисляется с поверхности при температуре 1200°. Все минеральные кислоты, кроме HF, даже концентрированные и при нагревании не реагируют с ним. Плавиковая кислота реагирует с дисилицидом железа уже на холоду, а при нагревании быстро растворяет. Растворы щелочей на холоду не оказывают заметного воздействия на этот силицид, но при нагревании медленно разлагают его. Расплавленные едкие щелочи разлагают дисилицид железа очень быстро [23]. При нагревании его на воздухе или в кислороде в смеси с окислами щелочноземельных металлов происходит реакция при температуре 400°, а с ВаО—при температуре 329° со взрывом. В результате образуются силикаты [571]. [c.193]
В тигельных печах обычно нет термопары или термометра для измерения температзфы. О примерной температуре в печи судят по цвету нагретого керамического муфеля темно-красное каление — 700° С, ярко-красное — 950°С, желтое — 1100°С. Через 10—12 мин тигель осторожно вынимают, захватив тигельными щипцами. Расплавленный металл можно вылить в фарфоровую чашечку или на керамическую пластинку. Нужно подчеркнуть, что эту операцию целесообразно вьшолнять без задержки, не давая тиглю охладиться. При охлаждении металл может иногда пршшавиться к тиглю и тогда его трудно извлечь, не разбив тигель. Для восстановления выбирают оксиды низкоплавких металлов (температура плавления свинца 327° С, олова 232°С), чтобы получить расплавленный металл в лабораторных условиях. [c.79]
Температура покраснения металла при нагреве
Цвета каления – видимая окраска горячих предметов, вызванная их свечением, вследствие нагрева тел до определённой температуры (выше 500 °С).
Определение цветов каления (разогрева) — давний способ приблизительной оценки температуры деталей при термообработке, использовался при разогреве изделий до определённой температуры, перед закалкой или отпуском.
По мере нагревания металлов их цвет меняется. Для сплавов железа, углеродистых сталей, при нагреве до температур выше 200 С появляются интерференционные цвета – т.н. цвета побежалости, видимые только в отражённом свете. При дальнейшем нагреве с температуры приблизительно 450-500 С становится заметен цвет, связанный с тепловым излучением материала.
Содержание
Физика происхождения цветов каления [ править ]
Применение цветов каления в технике [ править ]
Большое значение имеет, в частности, разогрев режущего инструмента, особенно дорогостоящего, например, модульных червячных фрез после закалки и последующей окончательной финишной обработки профиля фрезы перед упрочняющим плазменным напылением карбидами титана в специальных вакуумных установках. При этом происходит нагрев деталей. Так при нагреве при температуре отпуска и последующим напылении карбидной пленкой порядка 2-3 мкм, инструмент теряет твёрдость термообработки 62-64 HRC (Твёрдость по Роквеллу по шкале C) [1] и признаётся негодным. Долгое время за нагревом инструмента следили визуально через смотровые окна по цвету побежалости. Нагрев необходим для лучшей диффузии и сцепления паров карбида титана в плазменном состоянии при осаждении на рабочую поверхность инструмента. При этом стойкость инструмента перед первой заточкой возрастает в 3-6 раз. Например, инструменты, изготовленные за рубежом имеют повышение стойкости порядка в 10-15 раз.
В настоящее время контроль нагрева осуществляется специальными точными приборами, имеющими температурные датчики – пирометрами.
ЦВЕТА ПОБЕЖАЛОСТИ – радужная окраска, возникающая на чистой поверхности нагретого металла в результате появления на нем тонкого слоя оксидов. цвета побежалости, характерные для углеродистой стали, смотри в таблице
Температуpa, °С Цвет побежалости
220 Соломенный
230 Золотистый
240 Коричневый
250 Красно-коричневый
260 Пурпурный
280 Фиолетовый
300 Синий (васильковый)
320 Светло-голубой
330-350 Светло-серый
Да ещё кто-то ответ выбрал лучшим. А это, как говорят, -«Я Тебя про Фому, а Ты мне про Ерёму.»
Е сли постепенно нагревать сталь, то при низких температурах нагрева, на гладко отделанной поверхности не замечаем никаких перемен относительно цвета и блеска. При нагреве за 200 °С, появляется легкая побежалость (бледно-желтого цвета), которая с повышением до 400° принимает по очереди все оттенки радужных цветов, начиная от желтого до синего.
Выше 400° на поверхности уже замечается серая пленка, которая почти не изменяется до 495°; при этой температуре предмет принимает буро-красный оттенок, позволяющий различить в темноте его контуры. При дальнейшем подогреве начинают постепенно появляться разные цвета, по оттенку которых можно приблизительно определить температуру нагрева.
На приведенных фотографиях (нажмите для увеличения) из книги Thе Pеrfесt Edge: thу Ultimаtе Guidе tо Shаrpening fоr Wооdwоrkеrs (автор Rоn Hосk’s, прочитать книгу) хорошо видно изменение цвета при различных температурах нагрева стали. На левом фото нагрев составляет 648 °C, на центральном – 732 °C, на правом – уже 801 °C.
Сталь цвета нагрева — Энциклопедия по машиностроению XXL
При термической обработке необходимо соблюдать температурный режим, так как нарушение его может привести к браку. Для точного определения температурного режима используют различные приборы. Без приборов температуры устанавливают приблизительно. Обычно это делает опытный термист. Температуру определяют по цвету побежалости и излучению (цвету каления). Цвета побежалости — радужные цвета, возникающие в результате появления тонкого слоя окислов на чистой поверхности углеродистой стали при нагреве от 220 до 330 °С (табл. 9.1). Ими можно пользоваться при низком отпуске и закалке с самоотпуском. [c.175]Отпуск стали по цветам побежалости. Температуру отпуска часто определяют по цветам побежалости. Этот метод основан на наблюдении, показывающем, что светлая, зачищенная поверхность стали при нагреве окисляется, покрываясь тончайшей окисной пленкой. С повышением температуры отпуска толщина окисной пленки увеличивается и цвет поверхности изменяется. Каждому цвету побежалости свойственна определенная температура (табл. 6). Цвета побежалости зависят не только от температуры нагрева, но и от продолжительности нагрева, т. е. времени выдержки. [c.39]
Цвета побежалости. Это радужные цвета, возникающие в результате появления тонкого слоя окислов на чистой поверхности углеродистой стали при нагреве ее в интервале температур 150—350°С и на легированной стали при более высоких температурах. [c.90]
Посредством отпуска можно сообщить стали строго определенные механические свойства, уменьшить хрупкость и увеличить вязкость, что особенно необходимо для деталей, работающих при толчках и ударах. Чем выше температура отпуска, тем более вязкой становится сталь. Температуру отпуска контролируют по цветам побежалости, появляющимся на поверхности стали при нагреве. [c.532]
Если очищенный напильником или наждачной шкуркой кусок стали начать нагревать, то на его поверхности появляются различной толщины пленки окислов железа. Чем выше температура, тем толще пленка. С увеличением толщины цвет пленки меняется от светло-желтого (220°) до серого (325°). Эти цвета называются цветами побежалости и позволяют судить о температуре нагрева в пределах до 330°. [c.121]
Марка стали Режим нагрева Цвет полированной поверхности шлифа, видимой невооруженным глазом Цвет составляющих под микроскопом при увеличении 315-4Ю раз [c.54]
При нагревании стали до температуры выше указанной цвет металла также изменяется в зависимости от температуры. Цвет стали при нагреве выше 330° С называется цветом каления. [c.84]
Температуру самоотпуска нередко определяют по цветам побежалости, т. е. по цветам, появляющимся па шлифованной поверхности стали при нагреве до температуры 200—300° С и зависящим от толщины возникающей окисной пленки. [c.228]
| Таблица 3 Цвета нагрева стали при различных температурах |
Цвета нагрева стали 307 [c.781]
При нагреве стали выше 530° сталь начинает светиться. С повышением температуры свечение стали меняется. Цвета, принимаемые сталью при нагреве выше 530°, называются цветами каления. [c.70]
Температура и цвет нагрева при отжиге, закалке и отпуске резцов из быстрорежущей стали [c.114]
Температуру нагретой стали приближенно можно определить на глаз по цветам нагрева, приведенным в табл. 45. [c.112]
Определяют температуру нагрева по цветам побежалости или цветам нагрева стали непосредственно под ядром пламени (табл. 38). [c.238]
Цвет побежалости Температура в град. 1 Цвет нагрева стали Температура в град. [c.238]
При температурах от 330—350 до 530° С цвета побежалости не наблюдаются. При 530° С сталь начинает светиться. С повышением температуры свечение стали меняется и зависит от продолжительности нагрева. Цвета, принимаемые сталью при нагреве выше 530° С, называются цветами каления. Определить температуру по цветам побежалости и каления можно только при наличии соответствующего опыта работы. [c.75]
Из имеющейся в продаже окиси хрома, предназначенной, по-видимому, для применения в качестве пигмента, а не абразивного материала, получается довольно тупая паста. Значительно легче и быстрее достигается яркий блеск при пользовании окисью хрома приготовленной сжиганием хромпика (двухромовокислого натрия или двухромовокислого калия) с серой. Измельченный хромпик смешивают с измельченной серой (удобнее пользоваться мелким порошком серы, поступающим в продажу под названием серного цвета ) в соотношении 10 массовых долей натриевого хромпика на 1,4 части серы для получения примерно 6 частей окиси хрома или на 10 массовых долей калиевого хромпика 1,2 частей серы для получения примерно 5 долей окиси хрома (сера везде берется в небольшом избытке, а выход готовой окиси указан приблизительно, ибо он зависит от аккуратности работы при сжигании). Тщательно перемешанную смесь помещают на противень (предпочтительно из хромистой жароупорной стали) и нагревают до полного сгорания, остужают, размельчают, отмывают горячей водой от легкорастворимого сернокислого натрия (или, соответственно, — [c.143]
| Таблица 2. Цвета нагрева стали |
Сталь принимает закалку, начиная с марки Ст. 5 и. выше. Температуру нагрева при закалке обычно определяют по цвету раскаленного изделия (цвета накала). [c.19]
Примечание. Приведенное в таблице соответствие между температурой нагрева и цветом поверхности металла относится к углеродистым сталям. У легированных сталей такое соотношение не имеет места, так как они обладают большей стойкостью против окисления. [c.218]
Проведение травления довольно просто. Шлиф после полирования слегка подтравливают. Благодаря этому проявляются границы зерен и одновременно удаляется оказывающий вредное влияние на окончательные результаты деформированный слой. Некоторые авторы, например Скортези и Дюранд [56], рекомендовали неоднократное травление и полирование. Хорошо обезжиренный образец помещают полированной стороной вверх на медную плиту или песчаную баню и нагревают. За поверхностью образца следует непрерывно наблюдать. По достижении желаемой окраски шлифа образец охлаждают в ртутной ванне или, если не стремятся избежать слабого дополнительного развития цветов побежалости, на холодной металлической плите. Горячее травление на воздухе можно применять в первую очередь для незакаленных сталей при нагреве практически неизбежны изменения мартенсита. Несмотря на это, Ханке и Хенкель [57] травили этим методом мартенситные и аустенитные образцы при этом они смогли очень хорошо выявить обе фазы. [c.96]
Светлая закалка. При этом способе закалки детали нагревают в нейтральной безокислительной атмосфере или в расплавленных нейтральных солях. При светлой закалке нагрев деталей или инструмента осуществляют в жидких солях, не вызывающих окисления металла, с последующим охлаждением их в расплавленных едких-щелочах в нагревательных печах с применением контролируемой защитной газовой амтосферы, позволяющей регулировать взаимодействие печных газов со сталью при нагреве в вакуумных (10 —мм рт. ст.) закалочных печах. В результате выполнения любого из этих процессов можно получать детали с чистой светло-серого цвета поверхностью. [c.35]
И. В. Гутман [68] изучал влияние нагрева (60, 100, 200, 300, 400 и 500 °С) на защитные свойства фосфатной пленки, полученной из раствора железомарганцового фосфата (препарат ВИМ), на образцах из углеродистой, никелевой и кремнистой сталей. Образцы нагревали в муфельной печи в течение 1 ч при температуре опыта. Наблюдения показали, что при нагревании до 150 °С видимых изменений фосфатной пленки не наступало. В интервале температур 150—200 °С на отдельных образцах наблюдалось легкое пожелтение пленки, которое стало особенно заметным при нагревании выше 350 °С. При 500 °С фосфатная пленка приобрела бурый цвет. Изменение цвета пленки связано с образованием окисных соединений вследствие термического разложения вторичных и третичных фосфатов железа и марганца. Защитные свойства фосфатных пленок, подвергавшихся нагреву, определялись погружением в 3% раствор ]ЧаС1 и оценивались по продолжительности испытаний в нем до появления первых признаков коррозии (табл. 19). [c.57]
Отпуск обязательно производят после закалки в целях уменьшения хрупкости и внутренних напряжений, полученных при резком охлаждении стали. Температура нагрева при отпуске для инструментов — 200—320°, для деталей машин — 500—600°. Охлаждение производят в воде или на воздухе. Чем выше нагрев стали при отпуске, тем ббльшую вязкость она приобретает, но тем больше и падение твердости. Температура нагрева инструментов при отпуске может быть приближенно определена по цветам побежалости, т, е. цветам пленок окиси, образующихся на поверхности нагретого куска стали светло-желтый цвет соответствует 220—240° оранжевый — 240—260°, красно-фиолетовый— 260—280°, синий — 280—300°. [c.275]
Все конструкции до подачи их со склада на монтажную площадку рассортировывают по назначению, маркам и очередности монтажа и тщательно осматривают для выявления повреждений. Местные искривления, перегибы и вмятины выправляют обычно с подогревом дефектных мест ацетилено-кислородными резаками. Сталь следует нагревать до светло-красного цвета на участке, превышающем дефектный в 1,5—2 раза. Выпуклости и другие аналогичные дефекты выправляют кувалдой через гладилку. Удары наносят, начиная с краев и приближаясь к середине. В результате выпуклость растягивгется по всей площади. При нескольких выпуклостях, расположенных рядом, удары наносят по перешейкам, сводя все выпуклости к одной. Затем действуют, как описано выше. Профильные элементы выправляют переносными скобами или ручными домкратами. . [c.52]
При нагревании сталь окисляется, и на ее поверхности появляются пленки окислов, которые приобретают различную окраску, зависящую от толщины пленки и температуры нагрева. Такая окраска металла -называется цветом побежалости. При температурах свыше 330° С цвета побежалости исчезают. При нагревании стали свыше 330° С цвет ее также изменяется в зависимости от температуры. Цвет стали при нагреве выше 330° С называется цветом каления. В табл. 1 и 2 приведены цвета побежалости и каления стали, соответствующие определенным темпеоатурам нагрева. [c.28]
Термическое травление. Тщательно отполированный образец, который можно предварительно протравить в растворе 1.1 или 2.1, постепенно нагревают до красноватого цвета. Для этого образец помещают на нагретую до 300° С песчаную баню. Поверхность следует защитить от песка. Затем образец быстро охлаждают сжатым воздухом Ферритные зерна сильно окращиваются. Цементит также окрашивается, а большинство сложных карбидов не приобретают окраски и поэтому хорошо заметны. Для низкоуглеродистых сталей достаточно непродолжительного нагрева, чтобы выявить различие между фер-ритными зернами. Нержавеющие стали требуют нагрева до более высоких температур, так как аустенит окрашивается медленнее, чем феррит [1. 3, 40 421 [c.40]
Резкое падение прочности при высоких температурах (рис. 158, а) может привести к разрушению (проваливанию) твердого металла нерасплавившейся части кромок под действием веса сварочной ванны. В связи с высокой жидкотекучестью алюминий моягет вытекать через корень шва. Размеры сварочной ванны трудно контролировать, так как алюминий при нагреве практически не меняет своего цвета. Для предотвращения провалов или прожогов при однослойной сварке или сварке первых слоев многопроходных швов на большой погонной энергии необходимо применять формирующие подкладки из графита пли стали. [c.354]
На рис. 4-6 показана зависимость степени черноты от температуры для покрытия черный хром , полученного электроосаждением из. хромового ангидрида, растворенного в кремнефтористо-водородпой кислоте [53]. Степень черноты при температурах 815— 1100 К равнялась 0,89. После испытаний цвет покрытий из.менился с черного на зеленый. В течение первого определения излучательной способности (покрытие наносилось на подложку из нержавеющей стали) степень черноты в интервале указанных температур оставалась в пределах 0,88. Во время повторного нагрева степень черноты увеличилась с 0,89 при 815 до 0,92 яри 1100 К цвет образца также изменился с черного на зеленый. При увеличении темпе- [c.100]
На поверхности стальных шлифов при нагреве на воздухе образуются тонкие окисные слои, которые растут в зависимости от температуры и продолжительности травления. Наблюдаемые при этом цвета побежалости являются результатом интерференции. При микроскопическом наблюдении обнаруживают, что поверхность шлифа окрашивается на отдельных зернах одной и той же фазы в зависимости от ориентировки зерен относительно поверхности шлифа образуются слои разной толш,ины. Толщина окисных слоев также неодинакова на разных фазах в стали цементите и феррите. Это явление используют для получения цветных изображений структуры. [c.96]
Травитель 62 [термическое травление]. Нитрид железа, по данным Штрауса [50], выявляют при 250—300° С путем термического травления. Структурные составляющие, содержащие азот, окрашиваются быстрее. Феррит приобретает бледно-голубую окраску, перлит—темно-голубую, нитриды и зоны, обогащенные азотом, окрашиваются в красный цвет. В связи с этим Коэренс указывает на две картины окрашивания электролитического железа, азотированного в течение 12 ч при 250° С и нагретого до 250 С, и литой стали, азотированной в течение 8 ч при 850° С и нагретой до 280° С. В то время как в стали феррит выглядит красным, цементит (перлит) — фиолетовым, нитрид — голубым, в электролитическом железе феррит окрашивается в светло-желтый цвет, а нитрид — в интенсивный красно-коричневый. Чтобы всегда получать одинаковую картину окрашивания азотированного слоя для одного и того же материала, необходимо выдерживать постоянными температуру и длительность нагрева. [c.124]
При нагреве до синего цвета, что соответствует температуре 250 — 300° С, обработку стали производить нельзя, так как при этой температуре она становится очень хрупкой — синеломкой (фиг. 48). [c.497]
Д. К. Чернов ещё в 1868 г. установил наличие в стали критических точек (точки Чернова), в которых при нагреве и охлаждении происходят фазовые превращения. Первая точка, соответствующая тёмновишнёвому цвету каления стали, названа Черновым точкой а, вторая, соответствующая красному цвету каления,— точкой б. [c.476]
При температурах 200—300° С наблюдается снижение пластичности стали ( > и При этом уменьшение пластичности и вязкости стали в области тегчператур 200— 300° С носит название синеломкости, которое происходит от синего цвета побежалости при нагреве стали до 300° С. [c.41]
Отжиг концов труб из стали марок 15ХМ или 12МХ производится так же, как и углеродистых труб, но с нагревом до температуры 680—700° С (темнокрасный цвет металла) и выдержкой при этой температуре из расчета 3 мин. на каждый миллиметр толщины стенки. Затем трубы снимаются с горна и производится медленное охлаждение каждого конца, для чего он тщательно обертывается асбестовым матрацем или погружается в сухой, слегка подогретый песок. [c.198]
Гибка труб из углеродистых сталей может производиться с подогревом ТВЧ или газопламенной горелкой. Температура нагрева трубы — от 700 до 1000° С, при этом труба раскаляется до вишнево-красного цвета. Подогрев воздушноацетиленовым пламенем допускается также для гибки труб из алюминиевого сплава типа АМгМ при наружном диаметре трубы > 18 мм. [c.100]
Каленый и закаленный — в чем разница?
Эти понятия часто путают.
Термин «каление» в общем смысле означает «нагретый до высоких температур». И все. Применительно к металлам: достижение металлом определенной температуры сопровождается появлением характерного цвета – красного, желтого или белого. При нагреве в муфельной печи начало видимого свечения металла соответствует температуре порядка 600 оС. О цветах каления подробно сказано в Википедии:
| Температура, оС | Цвет каления |
| 550 | Темно-коричневый |
| 630 | Кроичнево-красный |
| 680 | Темно-красный |
| 740 | Темно-вишневый |
| 770 | Вишневый |
| 800 | Ярко- или светло-вишневый |
| 850 | Ярко- или светло-красный |
| 900 | Ярко-красный |
| 950 | Желто-красный |
| 1000 | Желтый |
| 1100 | Ярко- или светло-желтый |
| 1200 | Желто-белый |
| 1300 | Белый |
Цвет каления давал хорошее качественное представление о температуре металла – чем светлее, тем горячее. Поэтому тот кузнец, который мог лучше различать цвета и выбрать оптимальный цвет (= температуру), получал более качественные изделия.
(Понятно, что скверну выжигали каленым железом – самым эффективным, что было в арсенале средств борьбы. Понятно также, что это использовали и палачи – если железо красное, то точно будет больно, и очень. Относительно каленых орешков – их «калят», т.е. нагревают до высокой температуры для того, чтобы сделать скорлупу хрупкой и облегчить извлечение ядрышка. Т.е. в процессе нагрева орехов скорлупа меняет свои свойства. Собственно, то же самое относится и к семечкам. «Щелкать» можно только сушеные или жареные семечки, именно потому, что они сухие. С сырыми — не получится.)
Относительно металла. В первом приближении, если металл нагреть, а потом неспешно охладить, то по окончании охлаждения он будет таким же, как до нагрева (или почти таким же). На рисунке 1 показана структура армко-железа в исходном состоянии (рис.1, а) и после нагрева до 900 оС (рис.1,б). Видно, что размер зерна не изменился, а вот структура внутри зерна, скорее всего, изменилась. Могли измениться и свойства. Тот и другой образец травили одинаково, однако структура выглядит по-разному.
| а | б |
Рисунок 1. Армко -железо в исходном состоянии (а) и после нагрева до высоких температур (б).
Что касается стали, если нагреть ее до температуры существования аустенита, да еще выдержать при этой температуре, то может измениться размер аустенитного зерна; это окажет влияние на свойства. Но это уже дальше от нашей темы.
А вот если охладить сталь быстро, то состояние ее кардинально изменится. Это будет уже закаленная сталь.
Закалка стали – это вид термической обработки, который заключается в нагреве стали на 30—50 ºС выше критической точки (выше Ас1 для эвтектоидных и заэвтектоидных сталей и выше Ас3 для доэвтектоидных), выдержке при этой температуре и охлаждении со скоростью выше критической. Целью закалки является получение структуры мартенсита, который придает стали совершенно другие свойства.
Закалка имеет смысл только для сплавов с переменной растворимостью легирующих элементов при изменении температуры (есть «закалка вакансий», но это не тема данной статьи). Поэтому закалка, например железа, не имеет смысла с технологической точки зрения.
Закалка интересна именно большой скоростью охлаждения, поскольку позволяет 1) зафиксировать высокотемпературное состояние (например пересыщенный твердый раствор) и/или 2) создать структуру, имеющую определенные свойства, отличающиеся от свойств медленно охлажденного металла. Результат закалки показан на рисунке 2. В стали, не прошедшей закалку, структура представляет собой зерна феррита и перлита (рис.1, а). После закалки сталь имеет структуру мартенсита (рис.1,б) Соответственно, свойства стали до и после закалки будут разными.
| а | б |
Рисунок 2. Сталь до (а) и после (б) закалки.
Т.е., когда вместо «закаленный» говорят «каленый», это неверно.
В литературных источниках, в том числе в интернете, упоминаются каленые стрелы.Да, стальные стрелы могли иметь закаленный наконечник. Но не каленый. Вероятно, смешение понятий получилось потому, что сначала этот наконечник надо нагреть до температуры каления. Собственно, температура закалки для разных сталей составляет примерно от 850 до 1100 оС и лежит как раз в интервале цветов красного и желтого каления.
Есть еще интересный момент. Если стрелы (или наконечники к ним) ковали в кузнице, то для этого надо было их разогреть до высокой температуры. Это делалось на раскаленных углях, другого способа раньше не было. Т.е. имела место твердая цементация. Оптимальная температура цементации 830-850 оС, т.е. опять же попадаем в интервал температур красного каления. После изготовления наконечники охлаждалось в воде. Ну, а термической обработкой после цементации является, в том числе и закалка.
Насчет каленых деревянных стрел. Возможно, их обжигали на огне для придания лучших свойств. Тогда точно «каленая». Но это уже к специалистам по обработке древесины.
Подведем итог для металлов:
1. Каленый – претерпевший нагрев до высокой температуры, изменение свойств не предполагается;
2. Закаленный – прошедший термическую обработку (закалку) с целью изменения свойств.
Цветовая температура светодиодных ламп, что это такое || BATTERY TEAM
Цветовая температура светодиодных ламп, что это такое.
Светодиодные лампы неуклонно вытисняют люминесцентные лампы и тем более лампы накаливания. Одной из главной характеристик любой подобной лампы является цветовая температура и мы рассмотрим, в каком конкретном случае следует использовать тот или иной вариант цветового спектра.
Данная величина никоим образом не имеет связи с количеством тепла отдаваемой лампочкой в процессе работы, а характеризует собой визуальное восприятие человеческого глаза испускаемого света. И чем ближе сгенерированный цвет к естественному солнечному, тем “теплее” является свет данной лампы.
Для того, чтобы понять процесс получения того или иного спектра света и уловить суть ассоциаций можно рассмотреть следующий эксперимент, связанный с нагревом куска металла до определенной температуры. Где можно четко проследить зависимость повышения температуры и изменения свечения металла, начиная с красного и заканчивая фиолетовым светом.
Этот эксперимент позволил привязать цветовую температуру к вполне конкретному промежутку нагрева для приобретения требуемого цветового спектра.
Конечно в светодиодных лампах принцип получения определенного цвета несколько иной, но суть все та же. Чтобы получить требуемый оттенок требуется определенная цветовая температура.
Широкий выбор цветного спектра светодиодных лам позволяет создать в, казалось бы, одном и том же помещении совершенно различную атмосферу И в зависимости от того, спальня это или туалет, нужно с умом подходить к выбору освещения.
В этом случае нет универсального решения, ведь абсолютно все люди разные и одним комфортно при ярком полуденном свете (6500 К), а для кого-то милее теплый желтый цвет солнца у горизонта (3400 К).
Изначально не было выбора, так как стандартная лампочка Ильича выпускалась только с показателем в 3400 К. Но развитие индустрии галогеновых и диодных ламп привнесло в наш привычный обиход “холодный” свет.
Ориентируясь на следующие табличные значения, теперь можно легко представить лампу с какой температурой цвета вам лучше приобрести, например, в гостиную.
| Цветовая температура | Тип света | Где применяется |
|---|---|---|
| 2700 К | свет “теплый белый”, “красновато-белый”, теплая часть спектра | Характерно для обычных ламп накаливания, но встречается и в LED лампах. Используется в уютном домашнем интерьере, способствует отдыху, расслаблению. |
| 3000 К | свет “теплый белый”, “желто-белый”, теплая часть спектра | Бывает в некоторых галагеновых лампах, также встречается в LED лампах. Чуть жолоднее предыдущего, но также рекомендован для жилого фонда. |
| 3500 К | свет “дневной белый”, белая часть спектра | Создается флуоресцентными трубками и некоторыми модификациями светодиодных ламп. Подходит для квартир, офисов, общественных помещений. |
| 4000 К | свет “холодный белый”, холодная часть спектра | Незаменимый атрибут стиля хай-тек, но подавляет своей мертвенной бледностью. Используется в больницах и подземных объектах. |
| 5000 К — 6000 К | свет “дневной”, “бело-синий”, дневная часть спектра | Прекрасная имитация дня для рабочих и производственных помещений, теплиц, оранжерей, террариумов и т.п. |
| 6500 К | свет “холодный дневной”, “бело-сиреневый”, холодная часть спектра | Подходит для уличного освещения, освещения складских помещений и промышленных объектов. |
Данные о цветовая температуре можно увидеть практически на любой упаковке. Обычно в общем списке прочих характеристик приобретаемой лампочки. Так же множество производителей дополнительно дублируют эту информацию на цоколе своего товара.
Если вы решили правильно подобрать освещение у себя в кабинете или же дома, то можно, конечно, найти свой цвет путем проб и ошибок, но лучше обратиться к нормативной документации, а именно к СП 52.13330.2011 «Естественное и искусственное освещение», где можно найти следующие рекомендации в табличной форме:
Вывод
Как вы видите, данная характеристика является крайне важной и теперь при выборе новой светодиодной лампы, обращайте внимание не только на ценник и бренд, но и на цветовую температуру.
МЕТАЛЛОВЕДЕНИЕ ФИЗИЧЕСКОЕ | Энциклопедия Кругосвет
Содержание статьиМЕТАЛЛОВЕДЕНИЕ ФИЗИЧЕСКОЕ – раздел физики, изучающий процессы, происходящие в металлах на атомном и структурном уровнях. Понимание механизмов этих процессов дает возможность разработки новых технологий. Сведения о структуре и свойствах металлов на атомном и структурном уровнях получают с помощью физических методов исследования.
Люди узнали о существовании металлов еще на заре цивилизации. Они обнаружили, что некоторые камни, которые потом назвали рудой, при нагреве превращаются в блестящее вещество – металл, который при высокой температуре является жидкостью, а при комнатной – твердым телом. Они сделали еще целый ряд поразительных открытий. Оказалось, что мягкая медь и мягкое олово, перемешиваясь в жидком состоянии, превращаются в твердую бронзу. Для получения железа из руды пришлось сконструировать печи, дающие температуру нагрева в несколько раз выше температуры пламени костра. При этом добавление угля в железо превращало мягкое железо в твердую сталь.
Для практического применения металлов и изготовления металлических изделий (оружия, сельскохозяйственных орудий) надо было научиться обрабатывать металл. Оказалось, что если нагревать твердый металл, то при повышенной температуре он становится мягким, кузнец может его обработать, а при охлаждении металл опять становится твердым. При этом очень большое влияние на свойства металлов оказывают условия нагрева и охлаждения. При быстром охлаждении (закалке), например, в воде, свойства металла резко улучшаются.
Так, в виде рецептов, добытых трудами многих поколений, возникла технология обработки металлов. Некоторые из этих рецептов не разгаданы до сих пор, например, не удается полностью раскрыть рецепт изготовления клинков из дамасской стали (на Руси ее называли булатом). Эти клинки перерубали мечи из обычной стали и разрезали падающие на них шелковые платки.
Такая технология, основанная не на научном знании, а на жизненном опыте многих поколений, существовала до сравнительно недавнего времени, например, первые паровозы были построены на основе этой технологии). В то же время промышленная революция требовала разработки новых материалов и способов их обработки. Для этого необходимо было создание науки о физической природе свойств металлов – физического металловедения. Эта наука создавалась на стыке нескольких наук: химики научились определять состав металлов, физики создали приборы, позволяющие исследовать их структуру, механики создали установки для измерения механических свойств.
Химики выяснили, что технические металлы всегда содержат примеси, которые либо были в руде, либо попали в металл в процессе его выплавки. От природы и количества этих примесей зависят свойства металла. Следовательно, для изменения свойств можно вводить примеси. Металлические материалы, в которые вводится заданное количество других веществ, называются сплавами. Введенные вещества (химические элементы) называются компонентами (например, компонентами стали обычно являются железо и углерод).
Металлографический анализ.
Физики создали приборы для изучения структуры металлов. К таким приборам, прежде всего, относится металлографический микроскоп. Обычный микроскоп не удается применить для исследования металлов, т.к. в его оптической схеме свет от источника проходит через исследуемый образец, попадает в объектив микроскопа и через систему линз и окуляр попадает в глаз наблюдателя. Металл не пропускает световые лучи, поэтому для исследования металлов пришлось разрабатывать совершенно другую схему отражательного микроскопа. В этом типе микроскопа свет попадает на поверхность исследуемого образца, и после отражения попадает в объектив и в дальнейшем в окуляр микроскопа. Чтобы поверхность образца хорошо отражала свет, она должна быть отполирована до зеркального состояния, изображение можно сфотографировать через окуляр микроскопа.
Если сравнить друг с другом фотографии отполированных образцов из различных металлов, оказывается, что они не отличаются ничем, кроме цвета (медь красная, железо белое), и не дают информации о структуре материала. В такой ситуации пригодились исследования химиков, изучавших процессы растворения металлов химическими реактивами. Оказалось, что для каждого металла и сплава существуют реактивы (травители), которые позволяют растворить поверхность металла на глубину в доли микрона. При этом на поверхности образца выявляются микроскопические участки, имеющие разную конфигурацию, рельеф и цвет. Эта микроструктура дает необычайно ценную информацию, она меняется после нагрева и охлаждения сплава по различным режимам (термической обработки). Изучением микроструктуры занимается целая отрасль физического металловедения – металлография, созданы металлографические атласы с фотографиями микроструктур различных сплавов после различных обработок с увеличениями от 100 до 1000.
Итак, для проведения металлографического исследования нужно разрезать образец, отшлифовать и отполировать поверхность разреза (приготовить металлографический шлиф), обработать специальным реактивом для данного класса материалов (протравить), сфотографировать разные участки шлифа с различными увеличениями и сравнить с эталонными фотографиями в металлографическом атласе. На основании этих данных можно сделать заключение о химическом составе сплава, различных структурных составляющих и режимах предшествующей термической обработки.
Например, структура железа состоит из многоугольных зерен диаметром в несколько десятков микрон. На микрофотографии видно сечение этих зерен плоскостью шлифа. По данным химического анализа в железе содержится менее 0,01% углерода. При увеличении содержания углерода до 0,3% (этот сплав уже носит название сталь) появляется вторая структурная составляющая – зерна меньшего размера, имеющие полосчатую структуру. Многоугольные зерна носят название феррит, а полосчатые – перлит. При увеличении содержания углерода до 0,8% перлитная структура занимает весь шлиф. Таким образом, очень небольшое количество углерода (менее 1%) резко изменяет структуру стали. Феррит, перлит и другие структуры в сплавах носят общее название – структурные составляющие.
Структурные составляющие не обязательно являются однородными, они, в свою очередь, могут состоять из различных элементов, твердых растворов и химических соединений, которые называются фазами. В рассматриваемом случае в железе структура состоит из одной фазы. В тех сплавах, в которых в качестве структурной составляющей есть перлит, ситуация сложнее, т.к. перлит состоит из пластинок двух фаз – феррита и химического соединения Fe3C, которое называется цементитом. Формулу этого соединения определили химики, подобрав реактив, который растворяет железо (феррит). После растворения остается порошок, состав которого определили методами аналитической химии. Полоски представляют собой сечения пластин феррита и цементита плоскостью шлифа. Фазовый и структурный состав сплава не является постоянной характеристикой сплава данного состава и может меняться в зависимости от предшествующих и последующих режимов термической обработки. Так, если нагреть сталь до высокой температуры (в нашем случае до 860–900° С) и затем быстро охладить (например, бросить в воду), то ее фазовый и структурный состав может измениться. При этом для железа и стали с 0,3% С (малоуглеродистая сталь) микроструктура мало изменится, а для стали с 0,8% С она претерпит кардинальные изменения. Вместо полосчатой структуры перлита под микроскопом выявляется игольчатая структура с размерами иголок в десятки раз меньшими размеров пластин феррита и цементита в перлите. Эта структура носит название мартенсита. Меняя режимы нагрева и охлаждения,можно в том же материале получить и другие структурные и фазовые составы. Например, при облучении стали световыми импульсами лазера можно в тысячи раз увеличить скорость охлаждения. При этом мартенситная структура возникает даже в малоуглеродистой стали.
Таким образом, первый этап металлографического исследования – металлография позволяет получить информацию о морфологии элементов структуры. Для дальнейшей интерпретации этих данных необходимы другие методы исследования.
Электронная микроскопия.
При металлографических исследованиях структуры металла часто бывают необходимы большие увеличения. В обычном оптическом микроскопе предельное увеличение практически не более 1000, что связано с фундаментальными физическими причинами (длина волны света, коэффициент преломления света в линзах). Предельное увеличение в электронных микроскопах в сотни раз больше. В электронных микроскопах используется явление отклонения потока электронов в магнитном поле. Пучок электронов проходит через электромагнитные катушки (электронные линзы) действующие, как линзы в оптическом микроскопе, и объект исследования. Изображение объекта фиксируется на флуоресцентном экране.
Для исследования металлов применяется обычно сканирующий электронный микроскоп, в котором пучок электронов с помощью системы развертки сканирует поверхность образца. Отраженный электронный пучок, проходя через электронные линзы, создает увеличенное изображение объекта на экране. Увеличение в таком микроскопе порядка 10 000, т.е. в десять раз больше, чем в оптическом. Современные сканирующие микроскопы имеют еще ряд возможностей (исследование профиля поверхности, фотографирование во вторичных рентгеновских лучах).
В электронных микроскопах высокого разрешения электронный пучок может пробить металлическую фольгу толщиной порядка 1 мкм. Если из металла удается изготовить фольгу такой толщины, то можно получить увеличение еще в 100 раз больше.
При исследовании стали в сканирующем электронном микроскопе с увеличением 10 000, получены данные о структуре и конфигурации ферритных и цементитных пластин в перлите и изучены границы зерен в феррите, что существенно помогает при построении физического механизма процессов, происходящих при различных видах термической обработки.
Просвечивающая электронная микроскопия позволяет изучить процессы кристаллизации стали и атомные механизмы пластической деформации и разрушения.
Микромеханические испытания.
Основной характеристикой металлов и сплавов являются их механические свойства, т.е. способность выдерживать нагрузки и деформироваться. Разработано большое количество стандартных методов механических испытаний, например, испытания на растяжение. Это испытание состоит в растяжении образца в форме стержня с измерением приложенной нагрузки и удлинения образца. По результатам измерений определяется несколько механических характеристик, которые носят название предел текучести, предел прочности, относительное удлинение. Аналогичный набор механических характеристик определяется при испытаниях на сжатие, изгиб, кручение и другие виды приложения нагрузок. В измеренные величины механических свойств вносят свой вклад все зерна металла, и выделить вклад отдельных структурных составляющих не удается.
Для металлографических исследований свойств отдельных структурных составляющих сплавов нужно было разработать методы микромеханических испытаний.
Среди обычных методов механических испытаний есть распространенный метод измерения твердости. Твердостью называется сопротивление материала внедрению в него другого материала. В испытуемый образец вдавливается индентор из другого материала и измеряется глубина вдавливания. Естественно, материал индентора должен быть тверже материала образца. Твердость вычисляется исходя из величин нагрузки на индентор, формы и размеров индентора, глубины вдавливания. В минералогии применяется другой способ измерения относительной твердости минералов, более твердым считается минерал, которым можно нанести царапину на другом минерале. Существует даже шкала относительной твердости минералов (тальк, гипс, кварцит, флюорит, апатит, ортоклаз, кварц, топаз, корунд, алмаз), в этом списке каждый следующий минерал может царапать предыдущий.
Современная техника позволяет изготовить приборы для проведения измерения твердости в микромасштабе. В таком приборе для измерения микротвердости металлографический шлиф, предварительно протравленный для выявления структуры, исследуется под микроскопом, выбирается место для исследования, к этому месту подводится алмазный индентор, прикладывается нагрузка, после чего нагрузка снимается, шлиф возвращается в поле зрения объектива микроскопа и проводится измерение отпечатка. В микромасштабе сложно измерять глубину вдавливания индентора, легче измерить размеры отпечатка в плоскости шлифа. Если индентор имеет форму шарика, конуса или пирамиды, то по диаметру или диагонали отпечатка можно вычислить его глубину и определить твердость так же, как это делается при макромеханических испытаниях. В наиболее распространенном приборе для измерения микротвердости увеличение составляет до 400 и на микрошлифе стали хорошо видны отдельные структурные составляющие. Измерения их твердости показывают, что микротвердость феррита составляет около 100, перлита около 400, а мартенсита в закаленной стали около 800. Для того чтобы определить твердость всех фаз, увеличения прибора недостаточно, так, например, удается определить твердость перлита, но пластины фазы цементит (Fe3C) являются слишком тонкими, и поставить отпечаток на одну пластину не удается.
Метод измерения микротвердости при металлографических исследованиях во многих случаях позволяет получить результаты, недостижимые при макроскопических механических испытаниях. Например, измерения микротвердости участков с мартенситной структурой, возникших на месте зерен перлита в стали после действия световых импульсов лазера, показали, что их твердость почти в полтора раза выше, чем твердость стали после обычной закалки в воде. Этот эффект, имеющий большое научное и практическое значение, связан с тем, что нагрев и охлаждение металла при лазерной обработке происходит со скоростями в тысячи раз большими, чем при обычной закалке.
Микроспектральный анализ.
Принцип микроскопического наблюдения поверхности образца и зондирования выбранного участка осуществляется и в других приборах, применяемых в физическом металловедении.
Оптический спектральный анализ химического состава твердых тел основан на том, что материал испаряется, например, с помощью вольтовой дуги. При испарении материал переходит в плазменное состояние и начинает излучать свет. При этом каждый химический элемент дает свой набор длин волн излучения. Измеряя с помощью спектрографа длины волн излучения и соответствующие интенсивности света, можно провести качественный и количественный анализ химического состава изучаемого образца. В приборе для микроспектрального анализа под микроскопом на шлифе выбирается исследуемый участок и на него с помощью оптической системы направляется мощный световой импульс лазера, который фокусируется до диаметра около 1 мкм. Световой луч испаряет выбранный участок шлифа и возникает свечение образовавшейся плазмы, которое анализируется с помощью спектрографа. Для рассматриваемых сталей этим методом удается показать, что феррит является (в рамках чувствительности анализа) чистым железом, а перлит содержит углерод.
Рентгеновский спектральный анализ основан на том, что электронный пучок, попадающий на поверхность твердого тела при определенных условиях может возбуждать рентгеновское излучение химических элементов, входящих в образец. Это рентгеновское излучение может анализироваться рентгеновским спектрометром и таким образом можно идентифицировать химические элементы и определять качественный и количественный химический состав материала.
В приборе для микрорентгеноспектрального анализа, который обычно совмещается с электронным микроскопом, проводится микроисследование поверхности шлифа, затем на выбранный участок фокусируется электронный пучок и возникающее рентгеновское излучение анализируется с помощью рентгеновского спектрометра. Размер анализируемой области очень мал, диаметр пучка может составлять десятые доли мкм поэтому этот метод дает дальнейшее увеличение локальности анализа. В частности, для перлитной структуры стали можно провести отдельно анализ состава ферритных и цементитных пластин. Это исследование показывает, что феррит является практически чистым железом, что подтверждает результаты, полученные другими методами микроисследования. Для цементитных пластин этот метод исследования показывает, что они действительно состоят из железа и углерода.
При рентгеноспектральном анализе пучок электронов может перемещаться по поверхности образца, поэтому можно получить распределение этого химического элемента вдоль заданной траектории, например, распределение углерода в перлитных пластинах. Можно также получить фотографию в рентгеновском излучении анализируемого элемента. На снимке стали в рентгеновских лучах железа светится все поле, на снимках в рентгеновских лучах углерода светятся только полосы цементита.
Таким образом, использование химического анализа, металлографии и электронной микроскопии, измерения микротвердости, оптического и рентгеновского спектрального микроанализа позволило провести важные этапы металлографического анализа стали и определить конфигурацию структурных составляющих, общий и локальный химический состав, микротвердость до и после термической обработки. Все эти характеристики структуры определяются типом и расположением атомов в металле.
Современные физические методы позволяют изучить атомную структуру металлов, для этого используется дифракция рентгеновских лучей в кристаллах. Соответствующий метод исследования носит название рентгеноструктурный анализ.
Рентгеновское излучение.
В источнике рентгеновских лучей (рентгеновской трубке) электроны, вылетающие из нагретого катода, ускоряются электрическим полем и бомбардируют металлический анод. В материале анода возникает рентгеновское излучение – коротковолновое электромагнитное излучение со спектром длин волн. В рентгеноструктурном анализе обычно используются участки спектра, которые носят название характеристического излучения. Эти участки с узким интервалом длин волн генерируются в установках для рентгеноструктурного анализа. Соответствующие длины волн рентгеновских лучей составляют около 1 А (А – ангстрем равен 10–8 см). При этом каждый из обычно применяемых материалов анода (Сr, Fe, Co, Cu, Mo) дает свою длину волны характеристического рентгеновского излучения. Интенсивность рентгеновских лучей можно измерить с помощью детектора излучения (счетчик Гейгера-Мюллера, сцинтилляционный счетчик) с измерительной схемой, либо с помощью микрофотометра по почернению пленки, завернутой в черную бумагу и помещенной на пути луча.
При взаимодействии рентгеновского излучения с веществом происходит поглощение рентгеновского излучения, величина коэффициента поглощения зависит от атомного веса элемента и тем больше, чем больше атомный вес.
Кристаллическая структура металлов.
Металлы являются кристаллическими материалами, т.е. характеризуются трехмерной периодичностью в расположении атомов. При этом конкретное расположение атомов и расстояния между ними различны для различных металлов, совокупность атомов образует кристаллическую решетку. Характеристикой кристаллической структуры является элементарная ячейка – параллелепипед минимальных размеров, в вершинах, а также внутри которого расположены атомы и параллельным перенесением которого можно целиком заполнить пространство.
Для железа при комнатной температуре элементарная ячейка представляет собой куб с длиной ребра около 3 А, атомы железа расположены в вершинах и в центре куба (объемноцентрированная кубическая структура). При высоких температурах происходит фазовое превращение с перестройкой кристаллической структуры, в кубической элементарной ячейке происходит увеличение длины ребра куба и изменяется расположение атомов. В этой структуре (гранецентрированная кубическая структура) атомы расположены в вершинах куба и в центре каждой грани. Для описания кристаллической структуры в кристаллографии применяется система индексов. Так, например, грань куба в элементарной ячейке имеет индексы (100), диагональная плоскость, проходящая через 2 ребра куба – индексы (110), диагональная плоскость, проходящая через 3 вершины куба – (111). Обозначения индексов плоскостей пишутся в круглых скобках. Индексы направлений в кристаллической структуре совпадают с индексами плоскостей, перпендикулярных к этим направлениям, и записываются в квадратных скобках, например, [100], [110], [111].
Расстояния между атомными плоскостями являются характерными для каждого материала и, зная их, можно идентифицировать материал по его кристаллической структуре. Этот вид идентификации отличается от металлографии и электронной микроскопии, где изучается внешний вид структур под микроскопом и от оптической и рентгеновской спектроскопии, где изучается химический состав.
Дифракция рентгеновских лучей в кристаллах.
Чтобы определить межплоскостные расстояния в кристаллах, используют явление дифракции рентгеновских лучей. Дифракция возникает при взаимодействии первичного пучка рентгеновских лучей с атомами и проявляется в возникновении отклоненных (дифрагированных) лучей, распространяющихся под определенными углами к первичному пучку. В некоторых направлениях амплитуда вторичных волн складывается, находясь в одинаковой фазе, в результате чего возникает интенсивный отклоненный луч.
Если рассматривать кристалл, как совокупность параллельных атомных плоскостей, то дифракция (отражение) происходит на этих плоскостях. При угле падения первичного луча на атомную плоскость, равном q, отраженный луч составляет с первичным углом 2q.
Чтобы этот процесс реально проходил, необходимо соблюдение нескольких условий. Длина волны рентгеновского излучения должна быть близкой по величине к расстоянию между атомными плоскостями. В случае железа обе величины близки к 1А. Разность хода между двумя лучами, отраженными от соседних атомных плоскостей, должна быть кратной целому числу n длин волны рентгеновского излучения l. Это соотношение, которое называется законом Вульфа – Брэгга, имеет вид
n l = 2d sinq,
где n – целое число, называемое порядком отражения. Величина l известна, она определяется материалом анода трубки, величины q (или 2q) измеряются экспериментально и величина d вычисляется по уравнению Вульфа – Брэгга. Для практического применения этого уравнения нужно направить первичный пучок под углом q к выбранной системе плоскостей и зафиксировать отраженный луч, т.е. нужно знать, под каким углом данная кристаллографическая плоскость расположена к поверхности образца, что часто является трудной задачей. Гораздо проще исследовать технические материалы, которые, как, например, сталь, являются поликристаллическими, т.е. состоят из большого количества кристаллов, что хорошо видно при металлографических исследованиях. В поликристалле, состоящем из хаотически ориентированных кристаллов, есть большое число отдельных кристаллов, в которых атомные плоскости расположены под углом, удовлетворяющим закону Вульфа – Брэгга.
Получение рентгенограмм.
Исследуемый образец с плоской поверхностью помещается в рентгеновский гониометр – прибор, позволяющий проводить автоматический поворот образца на угол q и счетчика излучения на угол 2q. Гониометр является частью рентгеновского дифрактометра, включающего в себя еще рентгеновскую трубку с высоковольтной схемой, измерительное устройство и компьютер или потенциометр. Рентгеновский луч направляется на образец под небольшим углом, образец поворачивается автоматически и одновременно с вдвое большей угловой скоростью по кругу движется детектор. На потенциометре или экране монитора регистрируется кривая, по оси абсцисс которой откладывается угол q (или 2q), а по оси ординат интенсивность отраженных лучей. Измеряя углы, соответствующие максимумам интенсивности, определяют межплоскостные расстояния с помощью формулы Вульфа – Брэгга, и, сравнивая со справочными данными, проводят идентификацию материала образца. Полученные кривые интенсивности несут в себе еще много информации. Так, соотношения между тригонометрическими функциями углов отражения позволяют определить тип элементарной ячейки, а также индексы атомных плоскостей, участвующих в отражении.
Анализ распределения интенсивности в дифракционных максимумах позволяет исследовать и изменения в кристаллической решетке при изменении химического состава сплава, дроблении кристаллов, возникновении внутренних напряжений, ориентировке кристаллов и других процессах, происходящих при термической и механической обработке сплавов.
При металлофизических исследованиях приходится учитывать еще целый ряд факторов, усложняющих физическую интерпретацию результатов. Например, кроме используемого при анализе рентгеновского характеристического излучения, анод рентгеновской трубки излучает еще несколько с различной длиной волны, причем одна из этих длин волн очень близка к используемой, хотя излучение имеет меньшую интенсивность. Дифракция этих лучей создает дополнительную систему рефлексов, которые нужно учитывать при расчете или избавляться от них, устанавливая специальные фильтры. При интерпретации данных рентгеновского исследования металлов используются также результаты, полученные в смежных научных областях, прежде всего в кристаллографии. Комплексный анализ рентгеновских данных позволяет установить в кристаллах, состоящих из одного или нескольких типов атомов, не только их кристаллическую структуру, но и положения отдельных атомов в элементарной ячейке.
Рентгеновский анализ материалов можно проводить не только на дифрактометре с регистрацией счетчиками излучения, но и более старым способом – в специальных рентгеновских камерах с регистрацией на фотопленке. Этот метод дает важную дополнительную информацию, связанную с геометрическими характеристиками хода лучей. Дело в том, что отражение от поликристаллического образца имеет форму конуса, счетчик регистрирует интенсивность вдоль одной из образующих конуса, а на фотопленке, в зависимости от ее расположения, регистрируют различные сечения конуса, т.е. получают интегральную информацию.
Объем и специфические характеристики металлофизической информации, которую можно получить с помощью рентгеноструктурного анализа, иллюстрируют результаты исследования малоуглеродистой стали. Предварительные металлографические исследования показали, что структура стали состоит из зерен феррита и перлита, который в свою очередь состоит из пластин феррита и цементита. Съемка рентгенограмм шлифа проводилась на дифрактометре в излучении рентгеновской трубки с железным анодом с использованием наиболее интенсивного характеристического излучения с длиной волны 1,934 А. Кривые интенсивности (зависимости интенсивности дифрагированного излучения от угла q) позволили определить дифракционные углы и интенсивность соответствующих дифракционных максимумов, относящихся к данной длине волны рентгеновского излучения (другие длины волн отфильтровывались специальным устройством). На рентгенограмме зафиксированы 4 максимума с углами q 28,7; 42,6; 56,0; 73,10. По формуле Вульфа-Брэгга определены расстояния между атомными плоскостями кристаллов, участвующих в дифракции (межплоскостные расстояния), составляющие 2,01; 1,43; 1,17; 1,01A. Из результатов, полученных другими методами металлофизического исследования следует, что основной составляющей в исследованном материале является железо. Действительно, полученный набор межплоскостных расстояний, совпадает со справочными данными для железа.
Кроме рассмотренных методов в металлофизике применяют и ряд других методов, в том числе, использующих ядерный магнитный резонанс, эффект Мессбауэра и др.
Сейчас физические методы исследования время применяются и при изучении неметаллических материалов, таких, как полупроводники, ионные кристаллы, полимеры, стекла. За несколько десятилетий существования металлофизики как науки, удалось создать теорию и выяснить физические механизмы процессов, происходящих в металлах и сплавах при изменении состава, температуры, давления при пластической деформации и разрушении. Полученные научные и технологические результаты грандиозны по сравнению с тем, что было достигнуто за много веков путем накопления знаний эмпирическим путем.
Структура металлических сплавов.
Если в металл в расплавленном состоянии добавить примесь, то после охлаждения возникает металлический сплав, свойства которого сильно отличаются от свойств исходного металла. После медленного охлаждения сплава (для выполнения условия термодинамического равновесия) изготовляются шлифы, и проводится металлофизическое исследование. Фазовый рентгеноструктурный анализ позволяет установить наличие в сплаве одной или нескольких фаз, которые идентифицируются по набору межплоскостных расстояний. Фазовые превращения, т.е. переход из одной фазы в другую, могут происходить при изменении температуры. Определив фазовый состав большого количества (обычно сотен) образцов, можно узнать какой фазовый состав был у каждого сплава при всех температурах, и нанести соответствующие данные на диаграмму в координатах состав – температура. Отделив линиями области различного фазового состава, получают диаграмму состояния. По оси абсцисс на диаграмме отложена концентрация от 0 до 100%, по оси ординат температура от комнатной температуры до температуры плавления. Для типичной диаграммы состояния вдоль оси абсцисс (при комнатной температуре) характерно отсутствие изменений фазового состава вплоть до определенной концентрации примеси, затем появление другой фазы и смешанной структуры (этот процесс может повторяться несколько раз) и, наконец, существование однофазной области около второй оси ординат, соответствующей 100% второй составляющей. При повышении температуры границы между фазовыми областями перемещаются по отношению к оси абсцисс и таким образом возникает диаграмма состояния с областями существования различных фаз, разделенными границами. Области, прилегающие к оси ординат, называются областями твердого раствора, остальные области обычно связаны с образованием химических соединений между составляющими.
Твердый раствор – это кристаллическая структура, в которой имеются атомы примесей. При этом атомы примесей могут замещать атомы основы в элементарной ячейке (твердый раствор замещения) или внедряться между атомами основы внутрь элементарной ячейки (твердый раствор внедрения). Твердые растворы замещения возникают в сплавах, где обе составляющие являются металлами. В некоторых случаях взаимная растворимость составляет 100% (например, ювелирные сплавы Au-Ag). При растворении одного металла в другом меняются расстояния между атомными плоскостями, следовательно, происходит угловое смещение дифракционных кривых при сохранении их взаимного расположения. Для анализа твердых растворов удобно сравнивать не расстояния между отражающими атомными плоскостями, а длины ребер в кубической элементарной ячейке, в которые можно пересчитать величины межплоскостных расстояний. Длина ребра элементарной ячейки носит название периода кристаллической решетки. Если построить эталонную кривую зависимости периода решетки от концентрации примеси, то определение неизвестного состава сплава может быть проведено за несколько минут.
В технике составы твердых растворов приходится чаще всего определять при исследовании легированных сталей, в которые добавляются металлические составляющие (Сr, W, Ni и т.д.). Если в качестве примеси в сплаве на основе железа добавляют неметалл (например, С), то атом примеси не замещает атом основы, а внедряется внутрь элементарной ячейки, т.к. размеры атомов неметаллов существенно меньше размеров металлических атомов. При этом возникает твердый раствор внедрения. Примером твердого раствора внедрения является раствор углерода в железе, являющийся основой всех применяемых в технике сталей. При повышении температуры во многих металлах, в том числе в железе, кристаллическая структура меняется – аллотропическое превращение, в железе объемноцентрированная кристаллическая структура (атомы в элементарной ячейке расположены в вершинах и центре куба) переходит в гранецентрированную кубическую структуру (атомы в элементарной ячейке расположены в вершинах и центрах граней куба). На диаграммах состояния сплавов железа с другими элементами от температуры аллотропического превращения на оси ординат идет линия, соответствующая переходу от низкотемпературной к высокотемпературной фазе – линия фазового перехода. Низкотемпературная фаза на диаграммах состояния железо-углерод или железо-другой металл носит название феррит, высокотемпературная фаза – аустенит. При этом растворимость углерода в железе меняется от почти нулевой для феррита до 1,7% для аустенита. При дальнейшем увеличении содержания примеси обычно возникают химические соединения, состав соединения обозначен точкой на оси абсцисс и вертикальной линией на диаграмме состояния. При дальнейшем увеличении концентрации второй составляющей могут возникать соединения другого состава и, наконец, твердый раствор на основе другой составляющей. Реально на диаграмме состояния, как правило, имеются области существования нескольких фаз одновременно. Для сплавов железо – углерод это области существования феррита и химического соединения Fe3C – цементита. Малоуглеродистая сталь с 0,3% С состоит из фаз феррит и цементит. Фазы в сплавах могут образовывать различные структуры, наблюдаемые при металлографических исследованиях. Так в малоуглеродистой стали, структура состоит из двух составляющих – феррит (название фазы и структурной составляющей совпадают) и перлит, состоящий из двух фаз – феррита и цементита.
Металлографическое исследование сплава дает картину структурных составляющих, а рентгеновское исследование позволяет определить фазовый состав. Практически чувствительности рентгеновского метода исследования часто оказывается недостаточно для качественного и количественного определения второй фазы. В частности, обычные рентгеновские методы не позволяют определить наличие цементита в стали.
Свойства сплавов очень сильно зависят не только от химического, но и от фазового состава сплава. Сплавы со структурой твердых растворов имеют, как правило, высокую пластичность, а сплавы со структурой химических соединений высокую твердость и хрупкость. Реально в технике для достижения оптимального сочетания свойств применяют сплавы, состоящие из нескольких фаз. При разработке сплавов с заданными свойствами учитывают, что материалы, предназначенные для различных видов механической обработки давлением (прокатка, штамповка, ковка), которая проводится при высоких температурах, должны иметь при этих температурах структуру твердого раствора. Если при изготовлении и эксплуатации детали требуется высокая прочность и деталь не должна деформироваться, то целесообразно использовать сплавы, содержащие большую долю химических соединений. Среди железоуглеродистых сплавов такими свойствами обладают чугуны, содержащие очень много цементита.
Особенностью построения диаграмм состояния является то, что они представляют фазовый состав сплавов, находящихся в термодинамически равновесном состоянии. Однако резкие изменения температуры могут очень сильно изменять структуру и свойства сплавов. Примером может служить закалка стали – резкое охлаждение из области, где сталь имеет структуру аустенита. Этот вид воздействия на сплавы носит название термической обработки и его изучение имеет большое научное и практическое значение.
Физика термической обработки сплавов.
Нагрев высокоуглеродистой стали (0,8% С) до 800–900° С и резкое охлаждение в воде приводит к очень сильному изменению свойств, например, твердость увеличивается от 200 до 800 единиц, при испытаниях на растяжение сталь разрушается без пластической деформации. Ножовкой из закаленной стали можно распилить стержень из малоуглеродистой стали, из закаленной стали можно изготовить резец для токарного станка.
Для изучения физических процессов при закалке сплавов проводится весь комплекс металлофизических исследований и на основании их результатов создается физический механизм процессов при закалке. Фазовый и химический состав различных сплавов различен, поэтому физические механизмы процессов при закалке также отличаются.
Для сплавов со структурой твердых растворов, в которых нет фазовых превращений при нагреве, металлографический анализ показывает уменьшение размеров зерен, измерения твердости дают ее небольшое увеличение, рентгеноструктурный анализ показывает отсутствие изменений фазового состава и некоторое увеличение ширины кривых интенсивности на дифрактограммах. Эти результаты могут быть интерпретированы как измельчение зерен и возникновение внутренних термических напряжений в сплаве в результате резкого охлаждения.
Этот механизм характерен, например, для сплавов Au-Ag, образующих твердые растворы в полном интервале концентраций. В малоуглеродистой стали (0,3% С) возникает более сложная ситуация. Металлографическая структура этой стали при комнатной температуре – феррит и небольшое количество перлита, состоящего из пластин феррита и цементита. После закалки фазовая структура стали не изменяется, происходит только некоторое уменьшение размеров зерен. На диаграмме состояния в координатах «% С – температура» состав этой стали соответствует двухфазной области феррит – цементит с малым количеством цементита. Феррит не содержит С, цементит содержит 6,67% С. Здесь имеются в виду весовые проценты, содержание С в атомных процентах в цементите равно 25. Различие связано с большими различиями в атомных весах Fe и С. При повышении температуры феррит переходит в аустенит с гранецентрированной кубической структурой, а цементит распадается на Fe и С. При этом из-за большой скорости диффузии углерода при высоких температурах возникает аустенит, содержащий 0,3% С в соответствии с общим химическим составом стали. Согласно диаграмме состояния в аустените может растворяться до 1,7% С. При закалке эти процессы происходят в обратном порядке и в результате восстанавливается структура исходного материала.
В высокоуглеродистой стали (0,8% С) качественный фазовый состав тот же, но она целиком состоит из перлита, т.е. по 50% феррита и цементита. При нагреве в ней происходят те же процессы, что в малоуглеродистой стали, и возникает аустенитная структура. Однако, при резком охлаждении в аустените, содержащем 0,8% С, цементит не выделяется, а вместо феррита образуется другая структура, которая носит название мартенсит. Металлографически мартенсит представляет собой мелкоигольчатую структуру, не имеющую ничего общего с исходной. Рентгеноструктурный анализ показывает появление на рентгенограмме дополнительных максимумов интенсивности. Анализ рентгенограмм показывает, что элементарная ячейка железа меняет свою форму и из кубической становится тетрагональной, т.е. приобретает форму параллелепипеда. Это превращение происходит при температуре значительно ниже температуры перехода аустенита в феррит в равновесном состоянии.
Физический механизм процессов при закалке связан с тем, что в аустените, содержащем 0,8% С при охлаждении ниже температуры фазового перехода образуется пересыщенный твердый раствор внедрения. При этом в аустените, имеющем гранецентрированную кубическую структуру, атом углерода, имеющий размер значительно меньший, чем атом железа, может внедряться в центр элементарной ячейки, не создавая больших искажений силового поля в ячейке. При фазовом переходе возникает объемноцентрированная кубическая структура, в центре элементарной ячейки уже находится атом железа, так что внедренный атом углерода сильно искажает структуру и элементарная ячейка превращается в параллелепипед. Искажение кристаллической решетки и определяет высокие прочностные свойства сталей с мартенситной структурой.
Добавление в сталь дополнительных химических элементов (чаще всего металлов) сильно меняет процессы при закалке. Например, введение марганца приводит к резкому снижению границы фазового перехода аустенит – феррит или вообще исключает этот переход. Такая сталь при комнатной температуре имеет аустенитную структуру и высокую износостойкость.
Введение хрома и вольфрама приводит к возникновению твердых соединений металл – углерод (карбидов), которые не распадаются при нагреве и переходе в аустенитную область. Поэтому после закалки в структуре стали наблюдаются мартенсит и карбиды. Такая сталь, которая называется быстрорежущей, используется для изготовления инструмента, в том числе резцов для металлорежущих станков.
Закаленная сталь имеет высокую прочность и твердость, но пластичность у нее почти целиком отсутствует, что затрудняет ее практическое применение. Для повышения пластичности металл нужно перевести в равновесное состояние, что делают путем нагрева. Такая обработка носит название отпуск. Для изучения процессов при отпуске применяются все методы металлофизического исследования.
При повышении температуры размеры зерен увеличиваются, т.к. уменьшение площади границ зерен приближает материал к равновесному состоянию. Этот процесс носит название рекристаллизации и происходит во всех закаленных материалах независимо от их фазового состава. В тех материалах, где при закалке произошло фазовое превращение, при нагреве происходит перемещение атомов и уменьшение напряжений в кристаллической решетке. В частности, в высокоуглеродистой стали с мартенситной структурой уменьшается тетрагональность мартенсита и элементарная ячейка из параллелепипеда опять превращается в куб, прочность падает, а пластичность возрастает. Практической задачей при этом является нахождение режима, дающего оптимальное сочетание этих механических характеристик.
Повышение скорости диффузии атомов в твердом теле при повышении температуры можно использовать не только для разработки режимов отпуска, но и для изменения химического состава поверхностных слоев металлов. Для практического осуществления этого процесса поверхность металла приводят в контакт с другим материалом, находящимся в твердой, жидкой или газообразной форме. При достаточно высокой температуре (в районе 1000°С) происходит диффузия атомов насыщающего вещества вглубь металла и возникает поверхностный слой с измененным составом, структурой и свойствами. Этот метод, который носит название химико-термической обработки, особенно эффективен, если поверхность металлов насыщают неметаллическими элементами (С, N), имеющими малые размеры атомов.
Металлографическим и рентгеноструктурным методами контролируют возникновение новых фаз и процессы при термической обработке. В частности, при насыщении углеродом (цементации) малоуглеродистой стали на поверхности возникает слой высокоуглеродистой стали и после термической обработки сталь представляет собой мягкий материал с твердым поверхностным слоем.
Если сплав, имеющий структуру пересыщенного твердого раствора, выдерживается длительное время при невысокой температуре, то, несмотря на невысокие скорости диффузии атомов примеси, идет процесс приближения к термодинамическому равновесию. Этот процесс проявляется в выделении из твердого раствора частиц химических соединений, имеющих очень малые размеры. Непосредственное металлографическое наблюдение этих частиц удается провести только в наиболее мощных электронных микроскопах. Однако при рентгеноструктурном анализе обнаруживается, что период кристаллической решетки сплава (длина ребра куба элементарной ячейки) уменьшается. Этот эффект невелик, но тем не менее может быть обнаружен с помощью стандартной рентгеновской аппаратуры. Разработаны специальные методы прецизионного определения периода кристаллической решетки, применяемые в таких исследованиях.
Повысить точность измерения удается с помощью изменения геометрии съемки и разработки математических методов обработки результатов измерений.
Соответствующий вид термической обработки носит название старение и дает возможность повысить механические свойства сплавов, т.к. субмикрочастицы являются препятствием для пластической деформации. Примером эффективности старения является мягкий закаленный сплав алюминия с медью, который после старения превращается в прочный конструкционный сплав дуралюмин.
Если на диаграмме состояния сплавов, построенной в координатах, «концентрация – температура» ввести третью координату – время, то можно обнаружить дополнительные фазы, возникающие при длительной выдержке сплавов при высоких температурах. Сечения такой диаграммы при постоянной концентрации примеси в координатах время – температура носят название кривых изотермического превращения. Для стали с 0,8% С на этой диаграмме возникают области с новыми структурами, которые носят название бейнит и троостит.
Введение в состав сплава дополнительных элементов (это характерно для большинства технических сплавов) требует построения диаграмм состояния в многомерных пространствах. Для анализа структуры сплавов приходится строить двумерные или трехмерные сечения этих диаграмм.
Технический прогресс приводит к необходимости разработки новых физических методов исследования. Так, например, при действии световых импульсов лазера на металлические сплавы происходит плавление и кристаллизация сплава. Скорость охлаждения при этом настолько велика, что атомы не успевают образовать кристаллическую решетку, и при комнатной температуре возникает аморфный металл с хаотическим расположением атомов или нанокристаллы, упорядоченные только на нескольких межатомных расстояниях. Рентгенограмма такого сплава вообще не содержит дифракционных максимумов, а график угловой зависимости интенсивности дифрагированных лучей является кривой с одним максимумом (гало) на весь интервал дифракционных углов и для анализа рентгенограмм требуется дальнейшее развитие теории дифракции рентгеновских лучей.
Физика прочности и пластичности.
Металлофизические методы исследования и представления об атомной структуре кристаллов позволяют объяснить физические механизмы процессов при пластической деформации и разрушении металлов.
Если исследовать металлографическим методом структуру деформированного металла, то можно наблюдать ряд характерных особенностей. Так, в типичном металле – железе деформация вызывает появление системы параллельных линий в зерне. Направления линий, которые называют линиями скольжения, параллельны в пределах одного зерна, но различны в различных зернах. При увеличении деформации линии сливаются в более широкие полосы скольжения, внутри зерен или по их границам появляются трещины. Расположенные близко друг к другу трещины сливаются в магистральную трещину и, наконец, металл разрушается. Иногда полосы скольжения имеют структуру двойников, так называют полосы, состоящие из наклонных линий скольжения, расположенных симметрично оси полосы.
Измерения напряжения, необходимого для образования линии скольжения, были проведены на специально выращенных больших монокристаллах. Линия скольжения является сечением плоскости скольжения плоскостью шлифа. Если известна структура кристалла, то можно определить количество атомов в плоскости скольжения и вычислить напряжение, необходимое для сдвига в этой плоскости. Результат расчета дает величину на 3–4 порядка превышающую полученную экспериментально.
Чтобы объяснить это расхождение, теоретики высказали предположение, что сдвиг в плоскости скольжения распространяется постепенно, от атома к атому, т.е. для элементарного сдвига нужно преодолеть небольшое напряжение.
Элементарные носители пластичности были названы дислокациями. Дислокации представляют собой нарушения последовательности атомов – дефекты в кристаллической решетке. Эти дефекты являются линейными, т.е. в одном направлении они имеют большие размеры, вплоть до макроскопических (линия дислокации), а в двух других составляют несколько межатомных расстояний. Расчеты, проведенные с помощью дислокационных моделей, дают величины механических свойств, хорошо совпадающие с экспериментальными данными. Обычные методы металлофизического анализа позволяют получить только косвенные данные о механизме дислокационной пластичности и разрушения. Прямые экспериментальные доказательства существования дислокаций удалось получить только через несколько десятилетий после появления теоретической модели, когда появились электронные микроскопы, позволяющие наблюдать объекты атомных размеров. При этом оказалось, что атомная структура дислокаций, предсказанная теоретиками, полностью совпадает с экспериментально наблюдаемой.
При экспериментальном исследовании деформации кристаллов установлено, что скольжение идет в определенных плоскостях (сечениях элементарной ячейки) и в определенных направлениях. При этом плоскостью скольжения является плоскость с наиболее плотным расположением атомов, а направлением скольжения – направление, в котором атомы ближе всего друг к другу. Это объясняется тем, что при приложении напряжения к кристаллу, перемещение дислокации на межатомное расстояние определяется минимумом необходимой энергии. Например, в объемноцентрированной кубической кристаллической решетке железа, где атомы в элементарной ячейке расположены в вершинах куба и его центре, плоскость скольжения проходит через 4 вершины и центральный атом, а направление через две противоположные вершины и центральный атом. В кристаллографии приняты системы индексов для обозначения плоскостей (в круглых скобках) и направлений (в квадратных скобках). По этой классификации плоскость скольжения в объемноцентрированной структуре обозначается как (110), а направление скольжения, как [111].
При приложении напряжения к кристаллу дислокации первоначально движутся почти не встречая препятствий (стадия легкого скольжения). Затем дислокация доходит до препятствия (граница зерна, частица примеси, скопления других дислокаций). Для дальнейшего движения дислокации требуется увеличение напряжения (стадия упрочнения). Наконец, степень дефектности структуры доходит до уровня нарушения сплошности материала и возникает разрушение.
Металлофизические исследования позволяют уточнить механизмы отдельных процессов, проходящих во время деформации. Так, металлография показывает, что на стадии упрочнения происходит дробление зерен и повышение микротвердости. При рентгеноструктурном исследовании деформированных металлов обнаруживается расширение дифракционных кривых интенсивности, что интерпретируется, как эффекты дробления кристаллов и деформации атомных плоскостей. Оптической аналогией здесь являются отражение от зеркала с трещинами или изогнутого зеркала. Эффекты дробления зерен и искажения кристаллической решетки (микронапряжений) можно разделить вследствие различий угловой зависимости расширения дифракционных максимумов.
Справедливость теоретических механизмов деформационного упрочнения можно доказать и с помощью исследования эффектов, вызываемых движением отдельных дислокаций. Дислокации являются дефектами кристаллической решетки, нарушают правильность расположения атомов и влияют на свойства кристаллов, в том числе на химическую активность. Можно подобрать реактив, который будет растворять кристалл в области с искаженной кристаллической решеткой вокруг дислокации, и при растворении кристалла на поверхности образуются ямки в месте выхода линии дислокации на поверхность. Таким образом, в кристалле, содержащем небольшое количество дислокаций, можно под микроскопом наблюдать отдельные дислокации.
Если нанести на поверхность кристалла отпечаток индентора, прибора для измерения микротвердости, и протравить поверхность, то на ней возникнут ряды ямок травления, расположенные в виде лучей, идущих от поверхности отпечатка. Направления этих лучей совпадают с направлениями скольжения в кристалле. Реальный кристалл состоит из отдельных блоков, разделенных границами. Если поставить отпечаток вблизи границы, то можно убедиться, что дислокационные лучи упираются в границы, т.е. подтвердить теоретический вывод о том, что механизм упрочнения в кристаллах состоит в затруднении преодоления дислокациями препятствий.
В последние годы разработаны новые методы деформации и разрушения материалов концентрированными потоками энергии, для их анализа необходимо дальнейшее развитие металлофизики. Например, разрушение металлов световыми импульсами лазера или электронными импульсами требует для своего анализа учета процессов не только в твердом теле, но также в жидкости и плазме.
При соударении металлов со скоростями порядка нескольких км/с основную роль играют не прочностные свойства, а плотность. Поэтому твердое железо проникает в сталь на меньшую глубину, чем жидкая, но более тяжелая ртуть. Нужно также учитывать воздействие ударной волны и переход механической энергии в тепловую, в некоторых случаях нагрев составляет тысячи градусов.
Для описания различных видов деформации разработано большое количество дислокационных моделей и специальных методов металлофизических исследований. Например, при малых скоростях деформации важную роль играют пластические свойства материала, т.е. движение дислокаций, а при больших скоростях очень важны упругие свойства материала.
Лев Миркин
Оптика— Почему металлы светятся только красным, желтым и белым светом, а не во всем спектре?
Физика того, почему нагретый металл светится, как черное тело, уже выяснилась. были подробно рассмотрены в предыдущих ответах. Однако для того, чтобы полностью преодолеть разрыв с физиологией восприятия цвета (которая упоминалось в некоторых ответах) стоит показать изображение Планковский локус:
График по PAR, из Wikimedia Commons
Это набор всех цветов, которые может иметь черное тело, нанесенный на диаграмма цветности.Он вычисляется путем объединения черного тела формула излучения с функциями согласования цветов, которые являются математической моделью нашего цветового зрения.
Этот график ясно показывает путь горячего черного тела: красный → оранжевый → желтый → белый → синий. Теперь можно интересно, по какому совпадению он попадает прямо в белый, а не немного выше (через зелень) или ниже (через пурпурные). Однако это обратный вопрос. Хороший вопрос быть «Почему мы решили назвать« белый »цвет из Планковского локус ».Это вопрос определения белый , а это не простой.
На физическом жаргоне название white часто используется для обозначения «плоской квартиры». спектр », то есть такой, в котором мощность на единицу частоты не зависят от частоты. Говоря о реальных видимых цветах, однако имеет совершенно другое значение:
- Поверхность называется белой, если она почти полностью отскакивает назад. видимый свет, излучаемый на него.
- Свет считается белым, если он обычно выглядит как свет исходящий от белой поверхности.
Это оставляет понятие , в то время как свет плохо определен: свет идет от белой поверхности имеет тот же спектр, что и любой источник света (что означает: источник света) был освещен на него. Тогда свет от любого типичный источник света в некотором смысле можно рассматривать как «белый свет».
На практике в области науки о цвете существуют так называемые «Стандартные источники света», которые считаются белыми.В первую очередь D65 и D55. Они предназначены для моделирования естественного дневного света. Выбор дневного света в качестве эталонного источника света очевидно, учитывая, что наш вид имеет развивались в мире, где дневной свет всегда был стандартным светом источник, и, следовательно, наша естественная белая ссылка.
Спектр дневного света меняется в зависимости от погоды и высоты Солнце над горизонтом, но не слишком далеко от черного тела спектр. Что, наверное, не очень удивительно, учитывая, что Солнце сам по себе довольно неплохой черный кузов.
Оптика— Почему металлы светятся только красным, желтым и белым светом, а не во всем спектре?
Физика того, почему нагретый металл светится, как черное тело, уже выяснилась. были подробно рассмотрены в предыдущих ответах. Однако для того, чтобы полностью преодолеть разрыв с физиологией восприятия цвета (которая упоминалось в некоторых ответах) стоит показать изображение Планковский локус:
График по PAR, из Wikimedia Commons
Это набор всех цветов, которые может иметь черное тело, нанесенный на диаграмма цветности.Он вычисляется путем объединения черного тела формула излучения с функциями согласования цветов, которые являются математической моделью нашего цветового зрения.
Этот график ясно показывает путь горячего черного тела: красный → оранжевый → желтый → белый → синий. Теперь можно интересно, по какому совпадению он попадает прямо в белый, а не немного выше (через зелень) или ниже (через пурпурные). Однако это обратный вопрос. Хороший вопрос быть «Почему мы решили назвать« белый »цвет из Планковского локус ».Это вопрос определения белый , а это не простой.
На физическом жаргоне название white часто используется для обозначения «плоской квартиры». спектр », то есть такой, в котором мощность на единицу частоты не зависят от частоты. Говоря о реальных видимых цветах, однако имеет совершенно другое значение:
- Поверхность называется белой, если она почти полностью отскакивает назад. видимый свет, излучаемый на него.
- Свет считается белым, если он обычно выглядит как свет исходящий от белой поверхности.
Это оставляет понятие , в то время как свет плохо определен: свет идет от белой поверхности имеет тот же спектр, что и любой источник света (что означает: источник света) был освещен на него. Тогда свет от любого типичный источник света в некотором смысле можно рассматривать как «белый свет».
На практике в области науки о цвете существуют так называемые «Стандартные источники света», которые считаются белыми.В первую очередь D65 и D55. Они предназначены для моделирования естественного дневного света. Выбор дневного света в качестве эталонного источника света очевидно, учитывая, что наш вид имеет развивались в мире, где дневной свет всегда был стандартным светом источник, и, следовательно, наша естественная белая ссылка.
Спектр дневного света меняется в зависимости от погоды и высоты Солнце над горизонтом, но не слишком далеко от черного тела спектр. Что, наверное, не очень удивительно, учитывая, что Солнце сам по себе довольно неплохой черный кузов.
цветов нагреваемых металлов
цветов нагреваемых металловДо того, как стали доступны инфракрасные пирометры, кузнецы и другие мастера по металлу оценивали температуру нагретой стали и железа по его цвету. К сожалению, это невозможно сделать очень точно¹, особенно при температуре выше 1200 ° C.
Таблицы, сравнивающие температуру и цвет, появились по крайней мере еще в 1836 году (Пуийе). На рисунке ниже показаны три попытки корреляции температуры и цвета. Словесные описания, данные Хоу², Уайтом и Тейлором³, были опущены, а их температуры помещены в словесное описание в данных Halcomb Steel, которое было наиболее близко к их описанию.Вариация демонстрирует, насколько ненадежен этот метод даже в руках внимательных наблюдателей.
| Цвет | Halcomb Steel | Howe | Уайт и Тейлор |
|
|---|---|---|---|---|
| градус F |
градус C |
градус C |
градус C |
|
| Красное тепло, видимое в темноте | 752 | 400 | 470 | |
| Красное тепло, видимое в сумерках | 885 | 474 | ||
| Красное тепло, видимое при дневном свете | 975 | 525 | 475 | 532 |
| Красное тепло, видимое в солнечном свете | 1077 | 581 | 556 | |
| Темно-красный | 1292 | 700 | 550-625 | 635 |
| Тусклый вишнево-красный | 1472 | 800 | 677 | |
| вишнево-красный | 1652 | 900 | 700 | 746 |
| Ярко-вишнево-красный | 1832 | 1000 | 850 | 843 * |
| Оранжево-красный | 2012 | 1100 | 899 | |
| Оранжево-желтый | 2192 | 1200 | 950-1000 | 941 |
| Желто-белый | 2372 | 1300 | 1050 | 996 |
| Белый жар при сварке | 2552 | 1400 | 1150 | 1079 |
| Бриллиантово-белый | 2732 | 1500 | 1205 | |
| Ослепительно-белый (Голубовато-белый) | 2912 | 1600 | ||
* Тепло, при котором образуется и прилипает окалина (окалина на железе, нагретом до более высокие температуры падают при охлаждении утюга на воздухе).
Цвета для закалки
| Цвет | градус F |
градус C |
|---|---|---|
| Очень бледно-желтый | 430 | 221,1 |
| Светло-желтый | 440 | 226,7 |
| Бледно-соломенно-желтый | 450 | 232,2 |
| Соломенно-желтый | 460 | 237,8 |
| Темно-соломенно-желтый | 470 | 243.3 |
| Темно-желтый | 480 | 248,9 |
| Желто-коричневый | 490 | 254,4 |
| Коричнево-желтый | 500 | 260,0 |
| Пятнистый красно-коричневый | 510 | 265,6 |
| Коричнево-фиолетовый | 520 | 271,1 |
| Светло-фиолетовый | 530 | 276,7 |
| Полный фиолетовый | 540 | 282.2 |
| Темно-фиолетовый | 550 | 287,8 |
| Синий | 560 | 293,3 |
| Темно-синий | 570 | 298,9 |
| Очень темно-синий | 600 | 315,6 |
Источник: Halcomb Steel Co. (1908)
источников
1
Закалка и отпуск
Инструменты и металлы. —
Необходимые цвет и температура: —
Бледно-соломенный, 430 ° F.для ланцетов и т. д .;
темно-желтый, 470 ° F, для бритв и т. Д. ;
темная солома, 470 ° F, для складных ножей;
желтая глина, 490 ° F, для долот и ножниц;
коричнево-желтый, 500 ° F, для тесл и рубанков;
очень бледно-пурпурный, 520 ° F, для столовых ножей;
светло-фиолетовый, 530 ° F, для мечей и пружин для часов;
темно-фиолетовый, 550 ° F, для более мягких мечей и пружин для часов;
темно-синий, 570 ° F, для небольших пил;
синий, 590 ° F, для больших пил;
бледно-голубой, 610 Fah., для пил, зубья которых устанавливаются плоскогубцами;
зеленовато-синий, 630 Fah., Для очень мягкого характера.
Чтобы добиться должного закаления, положите металл на кусок железа, нагретый до достаточно сильного тепла в кузнице или другом огне. Таким образом, желаемый темперамент может быть обеспечен с величайшей легкостью и точностью, поскольку чистый блестящий металл наиболее отчетливо показывает степень окисления от синего вверх, причем окисление может быть остановлено по желанию. Чистота, а точнее яркость поверхности, очень важна.
Эрнест Спон.
Квитанции мастерских для производителей, механиков
и любителей науки.
Лондон: Э. и Ф. Н. Спон, [без даты, но 1873 г.]
Стр. 26.
Мы переформатировали его список для удобства ссылок.
2
Тринадцатая книга естественной магии: закаленной стали
Затем, как сказал Плиний, его обычно смягчают Оилом и укрепляют водой. Закаливать тонкие железные слитки в масле является обычным делом, чтобы они не стали хрупкими при закалке в воде.Ничто не побудило меня искать более высокие цели, чем этот определенный Эксперимент, Что Ойл может сделать железо настолько слабым и мягким, что его можно вырвать и сломать руками; а Водой оно может стать таким твердым и упрямым. , что он будет резать железо, как свинец.
…
Я сказал, как железо можно сделать мягче, теперь я покажу его закалку, как сделать его резче острее. По характеру он подходит для самых разных целей. Ибо железо требует некоторого темперамента, будь то резка Хлеба, Дерева, Камня или Железа, то есть различных спиртных напитков; и различные способы его поджигания, и время его растворения в этих спиртных напитках, ибо от них зависит дело.Когда железо раскалено докрасна, что не может быть горячее, когда оно мерцает, они называют его серебром; и тогда его нельзя гасить, иначе он сгорит. Но если он желтого или красного цвета, они называют его золотым или розовым: после закалки в ликерах он становится тверже: этот цвет требует, чтобы они его погасили. Но заметьте, что если все железо закаляется, цвет должен быть тусклым или фиолетовым, как лезвие Меча, Бритвы или Ланцета: ибо в них настроение пропадет, если они снова станут горячими.Затем вы должны обратить внимание на вторые цвета; а именно, когда железо закалено и погружено в него, оно становится твердым. Последний цвет — ясень: и после этого, если его закалить, он будет меньше всего затвердевать. Например:
Характер ножа для резки хлеба.
Я видел много изобретательных людей, которые работали для этого характера, у которых, имея ножи, пригодные для разрезания всех твердых веществ, но они едва ли могли впасть в гнев, чтобы разрезать Хлеб для стола. Я исполнил их желание с таким вспыльчивым характером.Для того, чтобы резать Хлеб, позвольте Сталь мягко закалить таким образом: Мягко нагрейте Сталь, которая, когда она ломается, кажется сделанной из очень мелких зерен; и пусть он будет отлично очищен от железа: затем ударил его молотком, чтобы сделать из него нож; затем обработайте его напильником, образуйте его, как нож, и отполируйте его колесом; затем поместите его в огонь , пока не появится фиолетовый цвет. Протрите его Sope, чтобы он имел лучший цвет от Огня; затем возьмите его из Огня и смочите его край льняной тканью, смоченной оливковым маслом, пока он не остынет; Итак, вы смягчите твердость Стали мягкостью Ойла и умеренным жаром.Мало чем отличается от этого,
Закалка железа для дерева.
Что-нибудь посильнее годится рубить дерево; но оно также должно быть нежным: поэтому пусть ваше железо приобретет тот же фиолетовый цвет, а затем погрузите его в воду: выньте его; и когда он появится пепельного цвета, бросьте его в холодную воду. Да и в
большой разницы нетХарактер для инструментов для крови.
Он закаливается в Ойле и твердеет; потому что он нежный и тонкий: если бы его закалили в воде, он был бы вырван и сломан.
Характер железа для Sythe.
После этого железо превращают в сизу, дайте ему нагреться до цвета золота, а затем охладите его в Ойле или смазать жиром, потому что это тонкое железо; и если бы его погасили в воде, он либо рассыпался бы, либо вырвался.
Порта Иоанна Крестителя. [Джамбаттиста делла Порта]
Natural Magick . Книга 13.
Лондон: Томас Янг и Сэмюэл Спид, 1658.
Первое известное издание книги делла Порта на латыни было опубликовано в Неаполе в 1558 году и стало международным бестселлером.В 1589 г. вышло значительно расширенное издание, это перевод. Личность переводчика неизвестна. В 1957 году компания Basic Books опубликовала факсимильное переиздание.
Делла Порта была чрезвычайно выдающейся фигурой в те годы, когда экспериментальные данные постепенно заменили авторитет древних писателей. Он основал, возможно, первое научное общество Otiosi, группу, которая собралась в доме делла Порта. Он много публиковался, а позже был вице-президентом Академии рысей.Галилей был одним из членов.
3
Отпуск . — Сталь в ее самом твердом состоянии является слишком хрупкой для большинства целей, необходимая прочность и эластичность достигаются отпуском — или, , снижением отпуска, , как его называют, — который выполняется путем нагрева закаленной стали. до определенной степени и быстро охлаждает. Необходимое тепло обычно определяется цветом, который поверхность стали приобретает из-за образовавшейся таким образом пленки оксида. Степень нагрева, которой соответствуют эти несколько цветов, следующая:
| При 430 ° очень слабый желтый цвет. При 450 ° бледно-соломенный цвет. |
Подходит для твердых инструментов, таких как молотки, сверла и т. Д. |
| При 470 ° полностью желтый. При 490 ° коричневый цвет. |
Для инструментов, требующих твердых кромок без эластичности; ножницы, ножницы, токарный инструмент и т. д. |
| При 510 ° коричневый с пурпурными пятнами. При 538 °, фиолетовый. |
Для инструментов для резки дерева и мягких металлов; такие как рубанки, ножи и т. д. |
| При 550 °, темно-синий. При 560 °, полностью синий. |
Для инструментов, требующих сильных кромок без особой твердости; долота, топоры, столовые приборы и т. д. |
| При 600 ° серовато-синий, граничащий с черным. | Для пружин, которые гнутся перед разрушением; пилы, лезвия и др. |
Если сталь нагревается выше этого значения, эффект процесса закалки разрушается.
Вт. Т. Иган, составитель.
Иллюстрированный каталог Hall, Kimback & Co .
Чикаго: компания, 1890 год.
Стр. 295.
Извините. Для этой страницы нет информации об участниках.
Copyright © 2002-2019 Sizes, Inc. Все права защищены.
Последняя редакция: 16 августа 2019 г.
Видя тепло | Причины появления цвета
Вулканы — яркий пример раскаленной расплавленной породы
В английском языке мы понимаем, что «раскаленный добела» более горячий, чем «раскаленный докрасна», в то время как «синий» обычно ассоциируется со степенью холода, например, «холодный синий» или «ледяной синий».«С точки зрения реальной температуры,« синий горячий »горячее, чем« красный ».
Что такое накал?
Накаливание — это излучение света твердым телом, которое нагревается до тех пор, пока оно не начинает светиться, или излучает свет. Когда железный пруток нагревается до очень высокой температуры, он сначала светится красным, а затем, когда его температура повышается, он светится белым. Лампа накаливания — это видимое тепло — процесс превращения тепловой энергии в световую.
Наше разговорный термин «раскаленный докрасна», «раскаленный добела» и т. Д. Является частью цветовой последовательности: черный, красный, оранжевый, желтый, белый и голубовато-белый, видимой, когда объект нагревается до все более высоких температур.Производимый свет состоит из фотонов, излучаемых, когда атомы и молекулы выделяют часть своей энергии тепловых колебаний.
Лампа накаливания образуется, когда горячее вещество выделяет части своей энергии тепловых колебаний в виде фотонов. Шкала Кельвина измеряет абсолютную температуру (изменение на 1 K эквивалентно 1 ° C), при этом 273 K эквивалентны точке замерзания воды. При средних температурах, скажем, 1073 К (800 ° C), энергия, излучаемая объектом, достигает пика в инфракрасном диапазоне с низкой интенсивностью в красном конце видимого спектра.При повышении температуры пик перемещается в видимую область и, наконец, в нее. Температурный диапазон, наблюдаемый на Земле, обычно от 100 К до 2000 К, производит электромагнитную энергию в основном в инфракрасном и видимом диапазоне света, что дает нам удобную шкалу цветовой температуры.
Что такое цветовая температура?
Можно сказать, что свет имеет цветовую температуру. Цветовая температура — это шкала, связывающая цвет света, излучаемого объектом, с его температурой.По мере повышения цветовой температуры излучаемый свет смещается в сторону более голубых оттенков. На практике фактическая температура отличается от цветовой, поэтому используются поправочные коэффициенты.
Весы используют цвета абстрактного объекта, называемого излучателем черного тела, который поглощает, а затем излучает всю энергию, которая достигает его. Эта шкала может быть применена к фотографической лампе или даже к солнцу, но ее также можно применить к любому источнику света, используя поправочные коэффициенты, чтобы учесть, что реальные поверхности не являются идеальными излучателями черного тела.
Для источников света, которые не зависят от накала, таких как флуоресцентный свет, мы используем коррелированную цветовую температуру (CCT). Эти источники света не будут производить свет в форме спектра излучения черного тела. Вместо этого им назначается коррелированная цветовая температура на основе соответствия между цветовым восприятием человека излучаемого ими света и ближайшей цветовой температурой излучателя черного тела.
Вот цветовая температура некоторых распространенных источников света:
|
||||||||||||||
Когда мы говорим о том, что синий свет — холодный, а красный — теплый, мы имеем в виду нечто очень отличное от цветовой температуры.Мы используем эти цвета, чтобы описать наше восприятие или передать настроение. Как это ни парадоксально, но синий-горячий на самом деле горячее, чем красный.
Излучение черного тела
Зачем использовать радиатор с черным корпусом в качестве стандарта, если такого нет?
Оказывается, излучение черного тела дает нам набор очень точных рабочих уравнений, которые связывают температуру объекта со светом, который он излучает. Исходя из идеала и используя закон Планка, мы можем предсказать распределение энергии по спектру для данной температуры.Полная излучаемая мощность рассчитывается с использованием закона Стефана-Больцмана. Длина волны пикового излучения и, следовательно, цвет, который доминирует для этой температуры, определяется законом смещения Вина. Знание идеального случая позволяет нам прогнозировать или рассчитывать фактические значения, корректируя несовершенства реальных горячих объектов.
При повышении температуры последовательность излучаемых цветов следующая: черный, красный, оранжевый, желто-белый, голубовато-белый.
Кривые излучения черного тела Планка при повышении температуры.Работа Планка по выводу этого уравнения привела его к прорыву в понимании квантовой природы материи. Эти кривые также показывают тенденцию смещения длин волн пиков с увеличением температуры, как предсказал Вин.
Наше определение «белого цвета» основано на излучении при температуре 5800 К у поверхности Солнца. Его пик около 550 нм (2,25 эВ) соответствует максимальной чувствительности наших глаз в той же области. Обычно это связывают с нашей эволюцией вблизи нашего Солнца.Независимо от того, насколько высока температура, сине-белый цвет — самый горячий цвет, который мы можем воспринимать.
Накаливание от солнца
Мы можем использовать цвет горячих объектов для оценки их температуры примерно от 1000 К, поскольку пиковая длина волны перемещается в видимый спектр. Лампа с вольфрамовой нитью накаливания, самый распространенный искусственный источник света на Земле, светится при температуре около 2854 К. Солнце — естественный источник накаливания, поверхность которого, фотосфера, имеет температуру около 5800 К.
Излучение поверхности Солнца со средней температурой около 5800 К дает нам наше определение белого цвета; его пиковая длина волны около 550 нм (2,25 эВ) отражается в максимальной чувствительности наших глаз в той же области, отражая наш эволюционный прогресс при воздействии солнечного света.
Считается, что солнечная энергия исходит от ядерных реакций синтеза в его ядре, при этом в центре Солнца расчетная температура составляет около 15 000 000 К.Когда эта энергия движется наружу к поверхности Солнца, она сначала передается посредством излучения (через слой, называемый радиационным слоем), который поглощается и повторно излучается при понижении температуры. Ближе к поверхности, через конвективный слой, конвекция становится доминирующим механизмом передачи энергии, поскольку солнечная плазма здесь менее горячая и плотная и не может поддерживать теплопередачу за счет излучения.
К тому времени, когда он достигает поверхности Солнца, фотосферы, он достигает температуры 5800 К, которую мы воспринимаем как видимый белый свет.
Помимо тепла и света, Солнце также испускает поток заряженных частиц (в основном электронов и протонов) с низкой плотностью, известный как солнечный ветер, который распространяется по всей солнечной системе со скоростью около 450 км / сек. Солнечный ветер и частицы с гораздо более высокой энергией, выбрасываемые солнечными вспышками, могут иметь драматические последствия для Земли, начиная от скачков напряжения в линиях электропередач и радиопомех до прекрасного северного сияния.
Ярко-белые цвета фейерверков — примеры накаливания.Металлы, такие как магний, при сгорании нагреваются до белых температур. других цветов, производимых на пиротехнических дисплеях , использует люминесценцию, а не накаливание.
Другие примеры ламп накаливания и их использование
Цвет накаливания используется для измерения температуры в радиационных пирометрах. Источники освещения, от примитивных свечей до источников света, дуговых ламп и современных ламп накаливания и ламп-вспышек, используют лампы накаливания; обычно цель состоит в том, чтобы избежать цвета и создать как можно более однородный белый свет.
Металлообработка в значительной степени полагается на лампы накаливания для определения отличительных изменений температуры по цвету. Кузнецы закаляют железо при высоких температурах, а ювелирам необходимо знать цветовую температуру конкретного металла, чтобы правильно его отжечь и подготовить к работе без недогрева или перегрева.
|
Кузнец вынимает раскаленный железный слиток из кузницы. |
Идеальные температуры отжига для серебра (слева) и золота обеспечивают показанные цветовые температуры: тускло-розовый для серебра и красный для золота. |
Что заставляет горячие вещи светиться?
Конфорка плиты светится красным, когда она установлена на максимум. Старомодная лампочка становится слишком горячей, чтобы с ней можно было обращаться после того, как она немного погаснет. Некоторые химические вещества при поджигании дают яркие цвета. Но почему кажется, что тепло и свет идут вместе?
Ответ кроется в мельчайшей единице материи, атоме . В центре атома находится ядро , которое содержит положительно заряженных протонов и незаряженных нейтронов .Отрицательно заряженный электрон существует в оболочках , которые являются областями, окружающими ядро. Оболочку также иногда называют энергетическим уровнем .
Атом углерода, показывающий протоны (P) и нейтроны (N) в ядре и электроны (e) в оболочках, которые показаны концентрическими кругами (© 2020 Let’s Talk Science).Как тепло можно превратить в свет?
Электроны — это то, что позволяет атомам вступать в химические реакции друг с другом.Они также вызывают излучение света некоторыми соединениями при нагревании.
У каждого электрона есть оболочка, которая является его «домашней базой». Когда он находится в этой оболочке, говорят, что он находится в основном состоянии . Основное состояние — это состояние с наименьшей энергией для этого электрона. При комнатной температуре большинство электронов находится в основном состоянии.
Когда тепло передается атому, он начинает вибрировать быстрее. Эта вибрация представляет собой форму кинетической энергии. Часть кинетической энергии передается электронам вокруг ядра.Это заставляет их «прыгать» из своей обычной оболочки в оболочку, находящуюся дальше от ядра. Когда электроны атома перемещаются таким образом с места, считается, что он находится в возбужденном состоянии .
Когда электрон в основном состоянии набирает энергию, он возбуждается и перепрыгивает на более высокую оболочку (© 2020 Let’s Talk Science).Это возбужденное состояние очень нестабильно, и электрон быстро возвращается в свою нормальную оболочку и в основное состояние. Когда это происходит, электрон высвобождает дополнительную энергию, которую он получил, в виде фотонов инфракрасного света .Эти фотоны невидимы для человеческого глаза.
Когда электрон в возбужденном состоянии теряет энергию, он испускает инфракрасные фотоны и возвращается в свое основное состояние (© 2020 Let’s Talk Science).Как лампочки зажигают свет?
Способность электронов преобразовывать тепло в инфракрасный свет можно использовать множеством интересных способов! Самый известный пример — лампа накаливания. Внутри стеклянной колбы находится небольшой кусок металла (нить , ) из вольфрама. Электрический ток пропускается через нить накала.Но это нелегко. Это потому, что нить накала действует как резистор. Резисторы нагреваются, когда через них проходит электричество. Настолько горячий, что выделяет достаточно энергии, чтобы нить накала светилась. По этой же причине элементы для приготовления пищи на электрической плите светятся красным при нагревании.
Знаете ли вы?
Вольфрамовая нить накаливания в лампе накаливания при использовании нагревается до более чем 2 000 градусов Цельсия!
Одна из причин отказа от использования ламп накаливания заключается в том, что большая часть потребляемой энергии — до 95 процентов — расходуется на нагревание нити накала, а не на производство света.Это пустая трата энергии!
Как работают современные лампочки (2014) от Minute Physics (2:57 мин).
Как зажигают свет фейерверк?
Fireworks также работает по тому же принципу. Фейерверки делают из различных соединений, содержащих металлы. При нагревании эти соединения дают свет разного цвета. Металлы, которые поглощают более высокие энергии, будут выделять более короткие длины волны света (например, синий свет), когда их электроны возвращаются в свое основное состояние.Металлы, которые поглощают более низкие энергии, будут выделять более длинные волны света (например, красный свет), когда их электроны возвращаются в свое основное состояние.
Соли металлов используются для создания многих цветов фейерверков (давайте поговорим о науке, используя изображение, сделанное Orchidpoet с iStockphoto).Знаете ли вы?
Производство цветов в фейерверках — это изящное искусство, и специалисты по фейерверкам очень тщательно следят за своими рецептами цветов!
Итак, вот оно. Тепло и свет идут рука об руку, создавая удивительные вещи.От освещения наших домов до освещения ночи!
При какой температуре тлеет сталь?
При какой температуре тлеет сталь?
900 ° F
Почему горячий металл светится красным?
Для металлов, когда они нагреваются, энергия электронов увеличивается. По мере увеличения энергии испускаемые фотоны попадают в длину волны видимого спектра. Когда испускаемые фотоны получают больше энергии, они достигают красной области видимого спектра.
Какая температура докрасна?
Температура «раскаленного» объекта
| Цвет | Температура | |
|---|---|---|
| ° С | К | |
| Возникновение красного тепла | 500-550 | 770-820 |
| Темно-красный накал | 650-750 | 920-1020 |
| Ярко-красный нагрев | 850-950 | 1120-1220 |
Насколько горячее стекло, когда оно красное?
около 798 К
Какой цвет меньше поглощает тепло?
Чем больше света поглощает объект, тем больше поглощается тепла, поскольку свет является энергией.Если вы считаете, что это цвет, черный поглощает больше всего тепла. Черный объект поглощает все длины волн света и не отражает ни одного. С другой стороны, белые объекты отражают световые волны всех длин и поэтому поглощают меньше всего тепла.
Насколько горячая докрасна медь?
около 700 ℃
Насколько горячая оранжевая горячая сталь?
Цвет инструментальной стали в зависимости от температуры
| 2000 ° F | Ярко-желтый | 1093 ° С |
|---|---|---|
| 1700 ° F | оранжевый | 927 ° С |
| 1600 ° F | Оранжево-красный | 871 ° С |
| 1500 ° F | Ярко-красный | 816 ° С |
| 1400 ° F | Красный | 760 ° С |
При какой температуре латунь становится красной?
Более высокая температура, скажем, от 750 до 800 градусов, сделает то же самое за несколько секунд.Если позволить латуни достичь более высоких температур (независимо от времени), она будет безвозвратно и безвозвратно сделана слишком мягкой. Латунь начнет светиться слабым оранжевым светом при температуре около 950 градусов (F).
При какой температуре алюминий становится красным?
Алюминий плавится при температуре около 600 ° C, а сталь — около 1400 ° C. Расплавленная сталь нагревается до белого каления, а расплавленный алюминий нагревается докрасна. Это цветовая температура и не имеет отношения к составу. Сталь на отметке 600 тоже раскалена докрасна, но твердая.
Какого цвета самый горячий металл?
цвета нагреваемой стали
| Цвет | Halcomb Steel | Уайт энд Тейлор |
|---|---|---|
| градусов F | градусов Цельсия | |
| Красное тепло, видимое в темноте | 752 | |
| Красное тепло, видимое в сумерках | 885 | |
| Красное тепло, видимое при дневном свете | 975 | 532 |
Какая температура раскалена добела?
Стирлинг
| Цвет | Температура [° C] | Температура [° F] |
|---|---|---|
| Прозрачный оранжевый | 1,200 | 2,190 |
| Белое тепло | 1,300 | 2,370 |
| Белый яркий | 1,400 | 2,550 |
| Белый ослепительный | 1,500 | 2,730 |
Какого цвета Вега?
бело-голубой
Какая звезда имеет более высокую температуру?
Звезды типа O
Насколько горячий центр самой горячей звезды?
Эта Киля может быть в 180 раз больше радиуса Солнца, а температура ее поверхности составляет 36 000–40 000 Кельвинов.Для сравнения: 40 000 кельвинов — это около 72 000 градусов по Фаренгейту. Итак, голубые гипергиганты, такие как Эта Киля, вероятно, являются самыми горячими звездами во Вселенной.
Какая звезда имеет температуру 6000К?
Самые горячие звезды излучают большую часть своей энергии в ультрафиолете и кажутся электрически синими, как горелка для дуговой сварки. Звезда Сириус — хороший пример голубой звезды… .Цвета и температура.
| Температура поверхности | Звезда | Цвет |
|---|---|---|
| 6000 К | Солнце | Желто-белый |
| 4000 К | Арктур | Персик |
| 3000 К | Бетельгейзе | Красный |
Какого цвета сталь при 1500 градусах? — AnswersToAll
Какого цвета сталь при 1500 градусах?
Цвет инструментальной стали в зависимости от температуры
| 2000 ° F | Ярко-желтый | 1093 ° С |
|---|---|---|
| 1500 ° F | Ярко-красный | 816 ° С |
| 1400 ° F | Красный | 760 ° С |
| 1300 ° F | Средний красный | 704 ° С |
| 1200 ° F | Тускло-красный | 649 ° С |
При какой температуре сталь становится белой?
2400 градусов F
При какой температуре синяя сталь?
Нагрейте сталь до температуры от 400 до 800 градусов по Фаренгейту, чтобы получить цвета окисления.При 480 градусах по Фаренгейту сталь становится коричневой, при 520 градусах — фиолетовой, при 575 градусах — синей, а при 800 градусах — серой.
Все ли металлы светятся при одинаковой температуре?
Разные металлы будут светиться при разных температурах из-за их разной способности удерживать электроны. Некоторые металлы очень слабо удерживают свои электроны, а некоторые очень крепко. Температура, при которой он светится, зависит от силы этой силы.
При какой температуре светится медь?
При температуре около 650–700 ° C он начнет светиться красным, но не будет очень ярким.Фактически, при обычном комнатном освещении он, вероятно, все еще будет выглядеть серебристым. Где-то около 1100–1200 ° C он будет довольно ярким, но его цвет изменится на более оранжево-красный.
Может ли свет вызвать нагрев металла?
Да, свет может нагревать металл, потому что свет несет энергию. Когда световая энергия поглощается, материал может измениться, например, стать теплее.
При какой температуре светятся предметы?
На практике практически все твердые или жидкие вещества начинают светиться при температуре около 798 К (525 ° C; 977 ° F) с умеренно тусклым красным цветом независимо от того, происходит ли химическая реакция, которая дает свет в результате экзотермической реакции. процесс.Этот предел называется точкой Дрейпера.
От чего светятся горячие предметы?
Резисторы нагреваются при прохождении через них электричества. Настолько горячий, что выделяет достаточно энергии, чтобы нить накала светилась. По этой же причине элементы для приготовления пищи на электрической плите светятся красным при нагревании.
Свет горячий?
Свет не горячий, энергия, которую он излучает, возбуждает поглощающие его молекулы. Возбужденные молекулы «энергичны», не обязательно «горячие».«Горячий» возникает из-за большого количества инфракрасного излучения, исходящего от чего-либо, например солнце. Но, как вы сказали, если вы дотронетесь до лампочки, вы почувствуете тепло.
Почему нагретый металлический объект сначала раскалился докрасна, а затем раскалился добела?
Атомы начинают вибрировать, все электроны сходят с ума и переходят в более высокие энергетические состояния, и, возвращаясь, излучают свет разных цветов. Если вы продолжите нагревать металл, он станет красным, светлеет ярко-оранжевым, прежде чем превратиться в белый, и даже синий (при условии, что металл не плавится !!!)
Красный горячее синего?
Поскольку на высоких частотах больше энергии, теоретически синий свет теплее красного.Красный свет имеет большую длину волны, чем синий свет; это означает, что синий свет имеет более высокую частоту, чем красный свет. Поскольку в более высоких частотах больше энергии, теоретически синий свет теплее красного.
Какого цвета самая горячая жара?
фиолетовый
Что, если бы солнце было синим?
Голубое солнце не изменит этого. Поскольку голубые звезды горят сильнее, чем красные и желтые звезды, Земля будет намного горячее до такой степени, что не будет атмосферы и, следовательно, не будет ничего, что могло бы рассеивать свет.Небо было бы черным, если бы там не было очень яркого солнца.
Что означает синее солнце?
Голубое солнце может означать: звезду подходящего спектрального класса O.
Какого цвета были бы растения, если бы солнце было синим?
Вокруг звезд, более горячих и голубых, чем наше Солнце, растения будут поглощать синий свет и выглядеть от зеленого до желтого или красного. Вокруг более холодных звезд, таких как красные карлики, планеты получают менее видимый свет, поэтому растения могут попытаться поглотить как можно больше его, заставляя их выглядеть черными.зеленые инопланетяне так устарели.
Насколько велико синее солнце?
В 29 раз больше, чем Солнце, это не самая большая из найденных звезд, но она самая яркая, ее светимость составляет 8,7 миллиона солнечных светимостью, а температура ее поверхности составляет около 53000К. У нее также есть где-то между 265 и 315 массами Солнца, что делает ее самой массивной звездой из всех обнаруженных.
