Презентация по теме «Коррозия. Способы защиты от коррозии» | Презентация к уроку по теме:
Слайд 2
Коррозией металла называют его разрушение под действие окружающей среды. Коррозия вызывается химической реакцией металла с веществами окружающей среды, протекающей на границе металла и среды. Чаще всего это окисление металла, например, кислородом воздуха или кислотами, содержащимися в растворах, с которыми взаимодействует металл.
Слайд 3
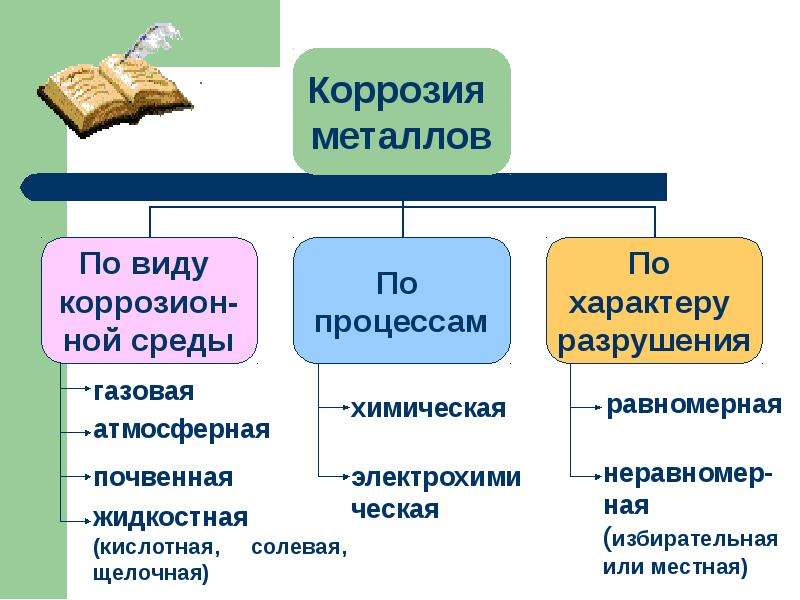
По типу коррозионного процесса различают химическую и электрохимическую коррозию. По виду агрессивной среды различают атмосферную, почвенную, жидкостную, газовую. По характеру разрушения материала различают равномерную, местную, межкристаллитную коррозию и коррозионное растрескивание. а – равномерная, б – местная, в – межкристаллитная, г – коррозионное растрескивание
Слайд 4
Химическая коррозия – процесс разрушения металла или сплава в результате чисто химического взаимодействия его с внешней средой. Электрохимическая коррозия возникает при действии на металл электролитов.
Слайд 5
1. Легирование. 2. «Нанесение» неметаллических пленок (оксидирование и фосфатирование) — воронение 3. Защита металлическими покрытиями (цинкование, кадмирование, алитирование, лужение, свинцевание, никелирование, хромирование, меднение 4. Обработка коррозионной среды
Слайд 7
Способы защиты от коррозии делятся на : 1. Пассивные (изоляция газопровода) 2. Активные (катодная и протекторная защита, электрический дренаж)
Слайд 8
Стальные трубы с наружным защитным покрытием из полиэтилена. Покрытия из экструдированного полиэтилена и полимерных липких лент . Покрытие наносится на стальные трубы в заводских условиях с использованием поточной механизированной линии по согласованному в установленном порядке технологическому регламенту или технологической инструкции.
Слайд 9
Основным способом защиты газопроводов от блуждающих токов является электрический дренаж. При отводе тока от газопровода по проводнику прекращается выход ионов металла в грунт и электрическая коррозия. Для защиты газопроводов от почвенной коррозии применяют катодную защиту.
Для защиты газопроводов от почвенной коррозии применяют катодную защиту.
Слайд 10
Рис. 1 Схема катодной защиты 1-источник постоянного тока, 2-защищаемый газопровод, 3-заземлитель-анод
Слайд 11
Рис. 2. Схема протекторной защиты 1-газопровод, 2-контроольный пункт, 3-кабель, 4-активатор, 5-протектор, 6-сердечник
Слайд 12
Перечень некоторых современных изоляционных материалов, предназначенных для защиты от коррозии: АСМОЛ, мастичная композиция для наружных комбинированных покрытий базового или трассового нанесения для защиты от коррозии линейной части магистральных газонефтепродуктопроводов диаметром до 1420 мм включительно, а также сварных швов; Двухкомпонентный полиуретановый материал без растворителей для ручного нанесения PROTEGOL® UR-Coating 32-55 L; Лента «ТЕРМА-СТ» — двухслойный изоляционный материал, поставляется в комплекте с «ТЕРМА-ЛКА» (замком). Температура эксплуатации — от -40 до +40°С. Лента «ТЕРМА-СТ 60» применяется при изоляции сварных стыков труб с двухслойным заводским полиэтиленовым покрытием и отводов; Мастика изоляционная с ингибитором коррозии МИК-1;
Слайд 13
Пленка ингибированная полиэтиленовая с антистатическим эффектом, содержащая летучие ингибиторы коррозии (ЛИК) и антистатические добавки (ингибиторы коррозии — химические вещества, в присутствии которых скорость коррозии замедляется). В пленку добавляется зеленый пигмент для придания ей характерного цвета, отличающего ее от других видов пленки; Фторэпоксидный однокомпонентный лак ФЛК-ПАсп. Покрытие этим лаком эластично и ударопрочно, стойко к истиранию, ремонтопригодно в местах повреждения. Срок службы подземной защиты — 20 лет, а надземной — 80. Растворитель — ацетон, способы нанесения — безвоздушное или пневматическое распыление, кисть, валик, налив; Эпоксидное покрытие ILAEPOX>1 мм для нанесения на внешнюю сторону емкости после пескоструйной обработки SA 2,5. Выдерживает испытание методом неразрушительного пробоя напряжением до 25 кВ.
Слайд 14
Спасибо за внимание!
Коррозия металлов — презентация онлайн
1.
 Коррозия металлов Автор презентации: учитель МБОУ
Коррозия металлов Автор презентации: учитель МБОУСОШ № 131 Цирина Т.А.
У металлов есть враг, который приводит к огромным
безвозвратным потерям металлов, ежегодно полностью
разрушается около 10% производимого железа. По
данным Института физической химии РАН, каждая
шестая домна в России работает впустую – весь
выплавляемый металл превращается в ржавчину.
Этот враг — коррозия.
Проблема защиты металлов от коррозии
возникла почти в самом начале их
использования. Люди пытались защитить
металлы от атмосферного воздействия с
помощью жира, масел, а позднее и
покрытием другими металлами и, прежде
всего, легкоплавким оловом (лужением). В
трудах древнегреческого историка Геродота
(V в. до н.э.) уже имеется упоминание о
применении олова для защиты железа от
коррозии.
В III до нашей эры на острове Родос был построен
маяк в виде огромной статуи Гелиоса.
Колосс Родосский считался одним из семи чудес света,
землетрясения. У Колосса Родосского бронзовая
оболочка была
смонтирована на
железном каркасе.
Под действием влажного,
насыщенного солями
средиземноморского воздуха
железный каркас разрушился.
В 20 годы ХХ в. по заказу одного миллионера
была построена роскошная яхта “Зов моря”.
Еще до выхода в открытое море яхта полностью
вышла из строя. Причиной была контактная
коррозия. Днище яхты было обшито медноникелевым сплавом, а рама руля, киль и другие
детали изготовлены из стали. Когда яхта была
спущена на воду. Возник гигантский
гальванический элемент, состоящий из катодаднища, стального анода и электролита – морской
воды. В результате судно затонуло, ни сделав ни
одного рейса.
Что является символом
Парижа? –Эйфелева
башня. Она неизлечима
больна, ржавеет и
разрушается, и только
постоянная
химиотерапия помогает
бороться с этим
смертельным недугом:
её красили 18 раз, отчего
её масса 9000 т
каждыйраз
увеличивается на 70 т.

Коррозия – разрушение металлов и
сплавов под воздействием окружающей
среды. Слово коррозия происходит от
латинского corrodere, что означает
разъедать.
8. Виды коррозии
9. Химическая коррозия
Химическая коррозия –это взаимодействие
металлов с сухими
газами и жидкостями –
неэлектролитами.
Такому виду коррозии
подвергаются турбины,
арматура печей и детали
двигателей внутреннего
сгорания.
10. Электрохимическая коррозия
Электрохимическаякоррозия – это все
случаи коррозии в
присутствии воды и
жидкостей –
электролитов.
11. Сущность коррозии.
Коррозия состоит издвух процессов:
химического – это
отдача электронов и
электрического – это
перенос электронов.
12. Закономерности коррозии:
1. Если соединеныдва разных металла,
подвергается только
более активный, и
пока он полностью
не разрушится, менее
активный защищён.
13. Закономерности коррозии:
2. Скорость коррозиитем больше, чем
дальше друг от друга
в ряду напряжений
расположены
соединённые
металлы.
14. Химизм коррозии.
15. Способы защиты от коррозии.
Одним из наиболее распространенныхспособов защиты металлов от коррозии
является нанесение на их поверхность
защитных пленок: лака, краски, эмали.
Широко распространенным способом защиты
металлов от коррозии является покрытие их
слоем других металлов. Покрывающие
металлы сами корродируют с малой
скоростью, так как покрываются плотной
оксидной пленкой. Производят покрытие
цинком, никелем, хромом и др.
17. Покрытие другими металлами.
В повседневной жизни человек чаще всеговстречается с покрытиями железа цинком и
оловом. Листовое железо, покрытое
цинком, называют оцинкованным железом,
а покрытое оловом – белой жестью. Первое
в больших количествах идет на кровли
домов, а из второго изготавливают
консервные банки.

19. Способы защиты от коррозии.
Создание сплавов сантикоррозионными
свойствами. Для этого
в основной металл
добавляют до 12%
хрома, никеля,
кобальта или меди.
20. Способы защиты от коррозии.
Изменение составасреды. Для
замедления коррозии
вводятся
ингибиторы. Это
вещества, которые
замедляют скорость
реакции.
21. Способы защиты от коррозии.
Применение ингибиторов – один из эффективныхспособов борьбы с коррозией металлов в различных
агрессивных средах (в атмосферных, в морской воде, в
охлаждающих жидкостях и солевых растворах, в
окислительных условиях и т.д.). Ингибиторы – это
вещества, способные в малых количествах замедлять
протекание химических процессов или останавливать их.
Название ингибитор происходит от лат. inhibere, что
означает сдерживать, останавливать. Известно, что
пользовались растворами серной кислоты с добавками
пивных дрожжей, муки, крахмала. Эти примеси были
одними из первых ингибиторов. Они не позволяли кислоте
действовать на оружейный металл, в результате чего
растворялись лишь окалина и ржавчина.
22. Электрозащита.
1. Протекторная защита.К основной конструкции
прикрепляются
заклёпки или пластины
из более активного
металла, которые и
подвергаются
разрушению. Такую
защиту используют в
подводных и подземных
сооружениях.
23. Электрозащита.
2. Пропусканиеэлектрического тока
в направлении,
противоположном
тому, который
возникает в процессе
коррозии.
24. Спасибо за внимание!
Презентация к уроку химии Коррозия металлов
Информация к размышлению
В начале ХХ в по заказу одного американского миллионера, была построена роскошная яхта «Зов моря». Днище её было обшито сплавом меди и никеля, киль и другие детали были изготовлены из листовой стали, скрепленной медными заклепками.
Днище её было обшито сплавом меди и никеля, киль и другие детали были изготовлены из листовой стали, скрепленной медными заклепками.
Когда яхту спустили на воду…
Тема урока: Коррозия металлов
Сущность коррозии:
Причины коррозии:
Факторы, влияющие на коррозию:
Коррозия — самопроизвольное разрушение металлов и сплавов под действием окружающей среды
Ржавление — процесс коррозии железа и его сплавов
Коррозия меди
Коррозия серебра
Коррозия
металлов
по
характеру
разрушения
по
процессам
по виду
коррозион-
ной среды
газовая
сплошная
химическая
атмосферная
местная
электрохимическая
почвенная
жидкостная
Химическая коррозия
2 Fe + O 2 = 2 FeO
4Fe + 3O 2 = 2Fe 2 O 3
8 Fe + 6 NO 2 = 4 Fe 2 O 3 +3 N 2
2 Fe + 2 H 2 S + O 2 = 2 FeS + 2 H 2 O
2 Fe + 3 Cl 2 = 2 FeCl 3
Fe + 2HBr = FeBr 2 + H 2 ↑
Химическая коррозия
происходит при воздействии на металлы сухих газов или жидкостей – неэлектролитов
(бензина, масла).
Последствия:
разрушение турбин, сопел ракетных двигателей, газопроводов
Электрохимическая коррозия
Fe 0 + 2 H + = Fe 2+ + H 2 0
Электрохимическая коррозия
Происходит в растворах электролитов, сопровождается возникновением электрического тока
+ 2+ 0
Fe + 2 H Fe + H 2
+ 0
Катод: 2Н + 2 е — Н 2 ( восстановление )
0 2+
Анод: Fe — 2 е — Fe ( окисление )
Электрохимическая коррозия
А нод(-) К атод(+)
Кислотная среда :
Fe — анод: Fe 0 – 2е — → Fe 2+ (окисление)
С u -катод :
Fe 0
Cu 0
—
—
—
—
—
Fe 2+
2Н + + 2е — → Н 2 ↑
Преобладание одного или другого процесса зависит от характера среды: в кислой среде – окислитель ион водорода, в нейтральной – растворенный кислород.
Среда нейтральная или щелочная:
На катоде :
восстановление кислорода ,
растворенного в воде
О 2 + 2Н 2 О + 4е — → 4ОН -,
и образование :
Fe (ОН) 2 Fe (ОН) 3 Fe 2 О 3 • n Н 2 О
4 Fe + 3O 2 + 6H 2 O = 4Fe(OH)
3Сущность коррозии:
переход металла в ионное состояние :
Me 0 – n е — → Me n +
Причины коррозии:
- активность металла
- агрессивность среды
Факторы, влияющие на коррозию:
1 группа
Луженое железо
( недеформированный образец )
+
раствор H 2 SO 4
Луженое железо
( деформирован
ный образец )
+
раствор H 2 SO 4
Оцинкованное
железо
+
раствор H 2 SO 4
№ 3
№ 1
№ 2
2 группа
Fe/Zn
Fe/Cu
Контроль
Fe
Тема проекта
Влияние продуктов коррозии металлов на развитие водных растений
Изучить влияние продуктов коррозии металлов на развитие водных растений, используя возможности цифровой лаборатории «Архимед»
(насадка рН-метр)
Цель работы
Результаты изменения рН
1 день
№ 1
Контроль
2день
6,79
№ 2 Fe
3 день
6,8
6,78
№ 3 Fe/Cu
№ 4 Fe/Zn
6,9
6,9
6,80
4 день
7
7
6,76
7,041
6,9
7,1
7,338
7,302
7
7,205
Состояние растений
во 2-м, 3-м,4-м стаканах по сравнению с контрольным -изменяется внешний вид растений: они буреют, сильно ослизняются.
Выводы:
- В образцах 2,3,4 – развитие растений нарушается в результате электрохимической коррозии железа
- медь увеличивает скорость электрохимической коррозии.
- Это подтверждают результаты эксперимента, а именно в 3-м стакане изменение значения рН больше по сравнению со 2-м образцом
3 группа
№ 2
№ 1
р-р NaCl + NaOH
р-р NaCl
4 группа
№ 1
№ 2
№ 3
№ 4
CaCl 2
(осушитель воздуха)
масло,
кипяченая дист.вода
сухой воздух, масло, дист.вода
влажный воздух, дист.вода
Факторы влияющие на коррозию:
- химический состав и структура металла
- наличие хлорид, сульфат –ионов
- влажность среды
- концентрация кислорода
Способы защиты металлов от коррозии
Электрохимические методы защиты
Что изображено на рисунках?
Установить причинно-следственные связи:
1. Металлическая кристаллическая решетка
2. Протекторная защита
3. Свойства металлов
4. Защита от коррозии
5. Металлическая связь
6. Добавление ингибиторов
7. Коррозия металлов
8. Неметаллические покрытия
Установить причинно-следственные связи:
1. Металлическая кристаллическая решетка
2. Протекторная защита
3. Свойства металлов
4. Защита от коррозии
5. Металлическая связь
6. Добавление ингибиторов
7. Коррозия металлов
- Неметаллические покрытия
5 1 3 2
6
7 4 8
КОРРОЗИЯ МЕТАЛЛОВ.
 МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ.
МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ.
Коррозия – это метод разрушения металла в результате его физико-химического взаимодействия с окружающей средой.
Коррозия самопроизвольный процесс. Химическая энергия коррозионного разрушения выделяется в виде теплоты и рассеивается в окружающем пространстве.
Различают химическую и
электрохимическую коррозию.
Химическая коррозия характерна для сред не электролитов. Происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды, и металл покрывается пленкой оксида или гидроксида.
Различают:
а) газовая коррозия – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах,
Например: окисление металла в кислороде воздуха при Т>>>298К;
б) коррозия в неэлектролитах – агрессивных органических жидкостях, например: в сернистой нефти.
Например, коррозия алюминия в сухом воздухе: 4А1 + 3О2 = 2А12О3
А10 –3е = А13+|4 О20 +4е = 2О2-| 3 Продукт коррозии пленка оксида алюминия.
Образующаяся пленка препятствует диффузии окислителя к чистому металлу и замедляет или прекращает дальнейшую коррозию
Способность пленки защищать металл от дальнейшей коррозии оценивают по её сплошности.
Сплошность -это отношение объёма продуктов коррозии к объёму окисленного металла (фактор Пиллинга – Бэдвардса).
Строение оксидной пленки.
Если в толщине образовавшейся пленки преимущественно движущиеся ионы кислорода, то это приводит к утолщению пленки за счет уменьшения толщины металла, т.е. общая толщина корродирующего образца практически не изменяется.
Если преимущественно перемещаются ионы металлов, то пленка растет в направлении газовой фазе (О2) и размер
корродирующего образца растет.
Может быть промежуточный случай – одновременного движения ионов кислорода и металла, что вызывает рост пленки в обоих направлениях.
Электрохимическая коррозия — характерна для сред, имеющих ионную проводимость.
Протекает:
а) в электролитах – в водных растворах солей, кислот и щелочей, в морской воде;
б) в атмосфере любого влажного газа; в) в почве.
При электрохимической коррозии происходит анодное растворение металла и катодное восстановление окислителя.
Окислители снимают избыточный отрицательный заряд с поверхности катода, уменьшая его поляризацию, поэтому их называют деполяризаторами.
В кислой среде рН < 7 на катоде протекает:
2Н+ + 2е = Н2 — деполяризация водорода В щелочной или нейтральной рН ≥ 7 на катоде протекает:
О2 + 2Н2О + 4е = 4ОН- деполяризация кислорода
Например, коррозия железа в среде: а) НС1 и б)КОН.
А) схема коррозионного элемента:
+2e |
|
А (-) Fе0 –2е = Fе+2 |
|1 |
↓———— |
| |
К (+) 2Н+ + 2е = Н2, т.е. рН< 7среда кислая |
|1 |
(-) Fе │НС1│ Fе (+) |
————————————————————— |
|
|
|__________↑ |
Fе0 + 2Н+= Fе+2 + Н2 |
|
|
-2e |
|
Fe +2НС1 = FеС12 + Н2 |
|
Б) схема коррозионного элемента:
|
+4e |
А (-) Fе0 –2е = Fе+2 |
|2 |
↓—————— |
| |
К (+)О2+2Н2О+4е= ОН-, рН >7 среда щелочная|1 |
|
(-) Fе│КОН+О2+Н2О│Fе (+) |
—————————————————— |
|
|
|_________________↑ |
2Fе0 + О2 + 2Н2О = 2Fе+2 + 4ОН- |
|
|
-2e |
|
|
|
|
|
О2 |
-Н2О |
|
|
2Fе + О2 + 2Н2О = 2Fе(ОН)2 → Fе(ОН)3 → FеООН |
|
Две последние стадии протекают только для железа.
По характеру разрушения поверхности металла:
а) Равномерная или общая коррозия – распределяется равномерно по всей поверхности образца.
б) Местная коррозия сосредоточена на отдельных участках и проявляется в виде точек, язв или пятен.
в) Межкристаллитная коррозия — по границам зерен.
Скорость коррозии выражают:
Массовый показатель — потеря массы (в граммах и килограммах) за единицу времени (сек, час, сутки, год), отнесенную к единице площади ( м2) испытуемого образца.
υкорр=Δm/Δτ∙ΔS
Глубинный показатель — уменьшение толщины металлы в единицу времени
υкорр=Δl/Δτ
Скорость электрохимической коррозии –
выражается величиной тока, приходящегося на единицу площади металла.
υкорр=I/ΔS
ЗАЩИТА МЕТАЛЛА ОТ КОРРОЗИИ.
А) Легирование – в сплав вводятся компоненты, вызывающие пассивность металла (Сr, Ni, W). Метод эффективный и недорогой. Придает сплавам жаропрочность и жаростойкость.
Жаростойкость – стойкость по отношению к газовой коррозии при высоких температурах.
Обеспечивается введением хрома, кремния, мышьяка.
Жаропрочность – свойства конструкционного материала сохранять высокую механическую прочность при значительном повышении температуры.
Жаропрочность увеличивается добавлением хрома, кремния.
Легирование используется:
А) с целью снижения скорости электрохимической коррозии, особенно коррозии с выделением водорода.
Б) для защиты от газовой коррозии.
Б) Защитные покрытия – это слои искусственно создаваемые на поверхности металла изделий и сооружений для предохранения их от коррозии.
Металлические покрытия Ими могут быть чистые металлы (цинк, кадмий, алюминий и др.) и их сплавы (латунь, бронза и др.).
Делят на катодные и анодные.
К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла (для железа – медь, никель, серебро).
При повреждении покрытия возникает коррозионный элемент:
А(-) Ме|среда|покрытие (+)К
Катодные покрытия защищают металлы от коррозии лишь в отсутствии пор и повреждений покрытия.
Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла (для железа –цинк).
При повреждении покрытия возникает коррозионный элемент:
А(-) покрытие |среда| Ме(+)К
В этом случае основной металл будет катодом коррозионного элемента, поэтому он не корродирует.
Металлические покрытия получают:
1)Металлизация:
Расплавленный металл с помощью струи сжатого воздуха наносится на защищаемую поверхность. Преимущества метода – можно наносить покрытия на собранные конструкции.
2) Термодиффузионный – изделие помещают в смесь, содержащую порошок металлического покрытия.
При повышенной температуре происходит диффузия наносимого металла в основной металл. Используются для получения жаростойких покрытий.
3) Химический – заключается в восстановлении соединений металла с помощью восстановителя.
Презентация на тему: Понятие о коррозии металлов. Способы защиты от коррозии»
1
Первый слайд презентации: Понятие о коррозии металлов. Способы защиты от коррозии»
Изображение слайда
2
Слайд 2: Девиз: «Знать – значит победить» Цель работы Задачи
Изучить коррозию металлов, исследовать причины и условия её возникновения. Актуальность
Практическое использование современных взглядов на коррозию металлов и сплавов и защиты металлических изделий от разрушения в быту и на производстве.
изучить сущность химической и электрохимической коррозии металлов;
закрепить представления об окислительно-восстановительных реакциях;
научить использовать приобретенные знания для объяснения явлений окружающей среды;
научить грамотному использованию металлических изделий;
проверить знания о строении металлов и их свойствах;
Актуальность
Практическое использование современных взглядов на коррозию металлов и сплавов и защиты металлических изделий от разрушения в быту и на производстве.
изучить сущность химической и электрохимической коррозии металлов;
закрепить представления об окислительно-восстановительных реакциях;
научить использовать приобретенные знания для объяснения явлений окружающей среды;
научить грамотному использованию металлических изделий;
проверить знания о строении металлов и их свойствах;
Изображение слайда
3
Слайд 3
Результат: прямые потери массы металла; косвенные потери — утрата важнейших свойств. Коррозия – рыжая крыса, Грызёт металлический лом. В. Шефнер Ежегодно в мире «теряется» до ¼ произведённого железа…
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
4
Слайд 4
Делийская железная колонна Эйфелева башня Высота 7, 2 м, вес около 6 тонн Возраст 1600 лет Красили 18 раз, отчего ее масса 9000 т каждый раз увеличивалась на 70 т (в сумме — 10260 т)
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
5
Слайд 5
Тема урока:
«Понятие о коррозии металлов. Способы защиты от коррозии»
Способы защиты от коррозии»
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
6
Слайд 6: Знать – значит победить» А. Н. Несмеянов
Цели урока: познакомиться с типами коррозии, со способами защиты металлов от коррозии; объяснить реакции окисления-восстановления, протекающие на поверхности металла в процессе коррозии.
Изображение слайда
Изображение для работы со слайдом
7
Слайд 7: Историческая страница
электрохимической коррозии.
Древнегреческий историк Геродот ( V в. до н. э. ) и древнеримский ученый Плиний старший ( I в. н. э. ) упоминают о применении олова для защиты железа от ржавчины.
В Х I Х в. Г. Деви и М.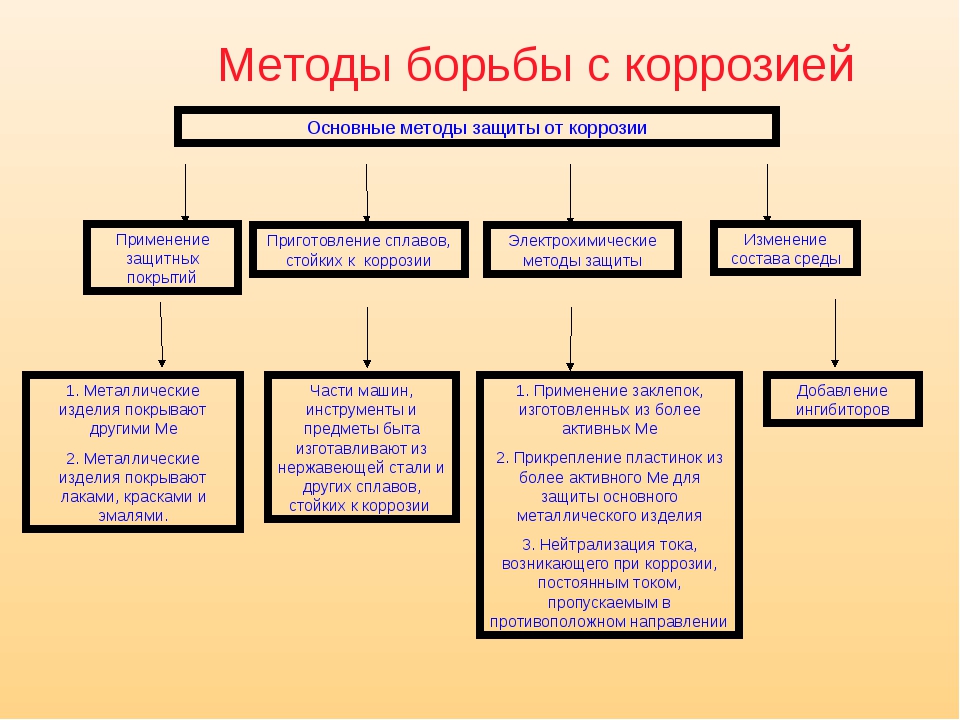 Фарадей изучают электрохимическую коррозию.
В 1830 г. Швейцарский ученый Де ла Рив сформулировал первую теорию коррозии.
В начале 30-х г. ХХ в. А. Н. Фрумкин изучал амальгамы металлов.
В 1935 г. А. И. Шултин и Я. В. Дурдин сформулировали теорию электрохимической коррозии.
Фарадей изучают электрохимическую коррозию.
В 1830 г. Швейцарский ученый Де ла Рив сформулировал первую теорию коррозии.
В начале 30-х г. ХХ в. А. Н. Фрумкин изучал амальгамы металлов.
В 1935 г. А. И. Шултин и Я. В. Дурдин сформулировали теорию электрохимической коррозии.
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
8
Слайд 8: Информационная страница
КОРРОЗИЯ – это разрушение металлов и сплавов под действием внешней среды. Коррозия – от латинского corrodere – разъедать.
Коррозия – от латинского corrodere – разъедать.
Изображение слайда
Изображение для работы со слайдом
9
Слайд 9
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
10
Слайд 10: Почему темнеет яблоко?
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
11
Слайд 11: Интересные факты
Изображение слайда
12
Слайд 12: Интересные факты
О том, сколь коварна и прожорлива коррозия, знают все автомобилисты. Двигатель порой готов еще служить верой и правдой, а кузов машины уже насквозь разъеден ржавчиной. Вот почему проблемам борьбы с коррозией ведущие автомобильные фирмы придают огромное значение.
Всеобщее внимание привлекли машины шведской фирмы «Вольво», которая сумела существенно повысить антикоррозионную стойкость своей продукции и дает покупателям гарантию на 8 лет
Двигатель порой готов еще служить верой и правдой, а кузов машины уже насквозь разъеден ржавчиной. Вот почему проблемам борьбы с коррозией ведущие автомобильные фирмы придают огромное значение.
Всеобщее внимание привлекли машины шведской фирмы «Вольво», которая сумела существенно повысить антикоррозионную стойкость своей продукции и дает покупателям гарантию на 8 лет
Изображение слайда
13
Слайд 13: Информационная страница
КОРРОЗИЯ – это окислительно-восстановительный процесс, при котором атомы металла переходят в ионы. В роли окислителя, как правило, выступают О 2 и Н +. Fe 0 — 2e → Fe 2+ Cu 0 — 2e → Cu 2+
Изображение слайда
Изображение для работы со слайдом
14
Слайд 14
с. 108-109 учебника
Изображение слайда
Изображение для работы со слайдом
15
Слайд 15: Химическая коррозия
Газовая В жидких не электролитах В нефти В сере В органических веществах 4Fe + 3O 2 + 6H 2 O = 2Fe(OH) 3
Изображение слайда
Изображение для работы со слайдом
16
Слайд 16: Электрохимическая коррозия
2Fe + O 2 + 2H 2 O = 2Fe(OH) 2 Fe — 2е — → Fe 2+ О 2 О 2 О 2
Изображение слайда
Изображение для работы со слайдом
17
Слайд 17
Виды коррозии
Изображение слайда
18
Слайд 18
По виду коррозионной среды
Изображение слайда
19
Слайд 19
Газовая Атмосферная Жидкостная Почвенная Блуждающими токами
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
20
Слайд 20: По характеру разрушений
Изображение слайда
21
Слайд 21: Сплошная коррозия
Равномерная Неравномерная
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
22
Слайд 22: Местная коррозия
Язвенная Точечная Пятнами
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
23
Слайд 23: Причины возникновения местной коррозии
Соль на дорогах Морская вода Межкристаллитная коррозия
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
24
Слайд 24: Факторы, влияющие на скорость коррозии
Экспериментальная страница
Изображение слайда
Изображение для работы со слайдом
25
Слайд 25: Цель:
исследовать влияние сред, контактов металлов на скорость коррозии
Изображение слайда
Изображение для работы со слайдом
26
Слайд 26
Гипотеза исследования
Коррозия металлов – химическая реакция, значит на её скорость может влиять контакт с другими химическими веществами.
Изображение слайда
27
Слайд 27: Метод исследования
Эксперимент
Изображение слайда
Изображение для работы со слайдом
28
Слайд 28: Что делали
1 стакан : Fe + H 2 O 2 стакан : Fe + р-р NaCl 3 стакан : Fe, Cu + р-р NaCl 4 стакан : Fe, Zn + р-р NaCl 5 стакан : Fe + р-р (NaCl + NaOH)
Изображение слайда
29
Слайд 29: Результат эксперимента
Изображение слайда
30
Слайд 30: Что наблюдали
Стакан №1. Железо слабо прокорродировало, в чистой воде коррозия идет медленнее, так как это слабый электролит.
Железо слабо прокорродировало, в чистой воде коррозия идет медленнее, так как это слабый электролит.
Изображение слайда
Изображение для работы со слайдом
31
Слайд 31
Стакан № 2. Скорость коррозии выше, чем в первом случае, следовательно, NaCl увеличивает скорость коррозии.
Изображение слайда
Изображение для работы со слайдом
32
Слайд 32
Стакан №3. Железный гвоздь в контакте с медной проволокой, опущенный в раствор NaCl сильно прокорродировал.
Изображение слайда
Изображение для работы со слайдом
33
Слайд 33
Стакан №4. В контакте с цинком железо не корродирует.
В контакте с цинком железо не корродирует.
Изображение слайда
Изображение для работы со слайдом
34
Слайд 34
Стакан №5. Железный гвоздь, опущенный в раствор NaCl, к которому добавили NaOH, не корродирует.
Изображение слайда
Изображение для работы со слайдом
35
Слайд 35: Вывод
Действительно, мы увидели, что скорость коррозии меняется в зависимости от контакта с другими химическими веществами. Коррозию железа усиливает контакт с менее активным металлом ( Cu) и присутствие в воде растворимой соли; уменьшает контакт с более активным металлом и наличие в воде щелочи. Из наблюдений можно сделать вывод, что алюминий для протекторной защиты использовать нельзя, так как железо все равно разрушается.
Изображение слайда
36
Слайд 36
Примеры коррозии
Изображение слайда
37
Слайд 37: Консервная банка
луженое железо Консервная банка
Изображение слайда
Изображение для работы со слайдом
38
Слайд 38: Оцинкованное ведро
Основа – железо, поверхность – серебристо-белый блестящий металл – Zn
Изображение слайда
Изображение для работы со слайдом
39
Слайд 39
Практическая страница
«Просто знать – ещё не всё,
знания нужно уметь
использовать». Гёте
Гёте
Изображение слайда
40
Слайд 40: Ингибиторы –
это вещества, способные в малых количествах замедлять протекание химических процессов или останавливать их.
Изображение слайда
41
Слайд 41: Практическая страница
Способы защиты металлов от коррозии: Шлифование поверхностей.
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
42
Слайд 42: Практическая страница
Способы защиты металлов от коррозии: Использование легированных сталей Практическая страница
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
43
Слайд 43: Практическая страница
Способы защиты металлов от коррозии: Нанесение защитных покрытий: Неметаллических (лаки, эмали, смазка, масла) Практическая страница
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
44
Слайд 44: Практическая страница
Способы защиты металлов от коррозии:
Нанесение защитных покрытий:
металлических (покрытие одного металла слоем другого)
Например никелирование, лужение, хромирование. Практическая страница
Практическая страница
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
45
Слайд 45: Практическая страница
Способы защиты металлов от коррозии: Нанесение защитных покрытий: Химических: Воронение, Оксидные пленки, Полимерные пленки И другие… Практическая страница
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
46
Слайд 46: Практическая страница
Способы защиты металлов от коррозии:
Электрохимические методы
Протекторная защита – к металлической конструкции присоединяется кусок более активного металла, который служит анодом и разрушается. Практическая страница
Практическая страница
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
Изображение для работы со слайдом
47
Слайд 47: Практическая страница
Способы защиты металлов от коррозии: Электрохимические методы: Катодная защита – конструкция присоединяется к внешнему источнику тока (так защищают трубы нефтепроводов и газопроводов) Практическая страница
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
48
Слайд 48: Практическая страница
Способы защиты металлов от коррозии:
Обработка среды
( В котельных установках из воды удаляется кислород. )
Практическая страница
)
Практическая страница
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
49
Слайд 49: Нанотехнология
Самовосстанавливающийся газопровод.
Изображение слайда
50
Слайд 50: Shewanella oneidensis — грамотрицательная, факультативно анаэробная бактерия
Изображение слайда
Изображение для работы со слайдом
51
Слайд 51: Стоп! Красный свет! »
Вопросы: Что такое коррозия? Какие виды коррозии вы знаете? Когда и кем была создана теория коррозии металлов? Когда и кем была сформулирована теория электрохимической коррозии? Как можно замедлить коррозию?
Изображение слайда
Изображение для работы со слайдом
52
Слайд 52: Задача
Сантехника попросили поставить водопроводный кран,
на стальную трубу. В наличии оказались хромированный и медный краны. Какой кран лучше выбрать? Аргументируйте ответ.
В наличии оказались хромированный и медный краны. Какой кран лучше выбрать? Аргументируйте ответ.
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
53
Слайд 53: Задача
Человек поставил на зуб золотую коронку, по истечении некоторого времени возникла необходимость в еще одной коронке, но средств на коронку у него нет. Возможен ли вариант, чтобы поставить на зуб стальную коронку? Что Вы можете предложить в решении данной проблемы?
Изображение слайда
Изображение для работы со слайдом
Изображение для работы со слайдом
54
Последний слайд презентации: Понятие о коррозии металлов.
 Способы защиты от коррозии»
Способы защиты от коррозии»
Изображение слайда
Изображение для работы со слайдом
Конспект урока и презентация по химии «Коррозия металлов»
Цель урока.
Дать понятие о коррозии металлов, ее видах, и способах защиты металлов от коррозии, а также раскрыть сущность химической и электрохимической коррозии.
Задачи обучения.
Формирование знаний коррозии. Познакомить с сущностью химической и электрохимической коррозии, со способами защиты металлов от коррозии.
Объяснить процессы окисления-восстановления, протекающие на поверхности металлов в результате коррозии.
2) Продолжить развивать научно-познавательную и коммуникативную компетенции, умения анализировать, выделять главное в изучаемом материале, делать выводы.
3) Воспитывать позитивное отношение к учению, прививать любовь к предмету, создавать комфортные отношения между участниками.
Оборудование: мультимедийный проектор, заранее приготовленные опыты демонстрирующие процесс коррозии, пробирки, серная кислота, цинковые стружки, держатель, спиртовка, спички и сухое горючее.
Ход урока.
1. Организационный момент.
2. Мотивация учебной деятельности.
Ведущая-сказочница(Сидит за столом, приговаривая) В тридевятом царстве, в металлическом государстве жили были металлы дружною семьей. А сколько вам известно металлов?(87) Однажды на царство металлов налетела злая колдунья –Коррозия.
А сколько вам известно металлов?(87) Однажды на царство металлов налетела злая колдунья –Коррозия.
Сколько беды она принесла металлам- не перечесть. Днем и ночью она ведет наступление по всему царству. Коррозия очень коварна, ведь она невидима и остается целой и невредимой, а металлы несут потери, да еще какие.Вчера ребятушки Коррозия захватила в заложники самый важный металл для человека, как вы думаете какой? (Fe). Перед вами стоит трудная задача. Чтобы победить врага и освободить Fe, мы должны узнать все тайны колдуньи и проникнуть в ее царство. Нам надо узнать о коррозии как можно больше,научиться с ней бороться. Именно поэтому, девизом нашей сказки будут слова
«Знать – значит победить». А Несмеянов. (Слайд№1).
Итак, ребята, в путь. Наш маршрут – царство коррозии. Ваши тетради – это ваши личные путевые дневники, не забывайте вести в них записи.
Под музыку группы «коррозия металлов» входит Колдунья- Коррозия.
Сказочница: Какая ужасная музыка! Мне плохо, голова разболелась! Ребята а вам нравится такая музыка? На мой взгляд, она разрушает человека так, как это делает коррозия с металлом! Коррозия:
Что я слышу? Испугались ! Правильно, я очень страшная и сильная,кто рискнет со мной бороться? Я слышала, что кто-то собирается меня победить, да еще и железо освободить ? Не получится, знаний маловато!
(слайд №2) Да знаете ли вы, что по подсчетам экономистов, ущерб, наносимый мною, во много раз превышает даже потери от такого страшного стихийного бедствия, как пожары? Огонь буйствует сравнительно редко, а я-то действую постоянно, ни на один час, ни на одно мгновение, не прекращая свою подрывную деятельность, Я держу в страхе металлы и сплавы всего мира. Около 15% всех производимых в мире металлов становятся ежегодно моими жертвами. Я их уничтожаю! Существенные убытки я причиняю даже косвенно. Утечки воды, газа, нефти из съеденного мною трубопровода. на отрезке,которое вы посчитаете неверным, прямая линия- верным.
на отрезке,которое вы посчитаете неверным, прямая линия- верным.
1 вариант- Медь.
2 вариант-Натрий.
Графический диктант.
1. Это активный щелочной металл.
2. Занимает 2-у место по электропроводности.
3. Это самый мягкий металл.
4. Металл входит в состав бронзы.
5. На внешнем электронном уровне два электрона.
6. Взаимодействует с водой при нагревании.
7. Не взаимодействует с водой.
8. В реакциях с галогенами выступает в роли окислителя.
9. Металл можно получить путем электролиза расплава его соли.
Раствор соли этого Ме используется для борьбы с вредителями сада.
10. Ме можно резать ножом.
11. Ме входит в состав тугоплавкого стекла.
12. Ме хранится под слоем керосина.
После окончания работы уч-ся обмениваются ключами, проверяют задания друг друга.
Коррозия: Посмотрим как вы справились с заданиями, верно ли начертили ключ- пропуск в мое царство?
(На доске вывешивается плакат с правильными ответами, и критериями оценок:5- без ошибок,1-2ошибки-4,3-5 ошибок -3).
Придется пропустить вас в мое царство, видно, что вы подготовились к путешествию, правда не все,те уч-ся, у кого ключ выполнен на 5-поедет в экспрессе с VIP номерами, у кого на 4 в плацкарте, у кого 3, не обижайтесь, для вас только дрезина
Весь материал — в архиве.
Антикоррозионная защита. Информация и способы защиты от коррозии.
Коррозия — это самопроизвольное разрушение металлов под воздействием химического или физико-химического влияния окружающей среды.
На сегодняшний день нет такой отрасли промышленности или объекта инфраструктуры в котором бы не применялись металлы. Экономический ущерб, нанесенного коррозионными разрушениями для предприятий нефтегазохимической промышленности, составляет около 50%. Это связано с влиянием на незащищенные поверхности металлоконструкций и оборудования, как агрессивных технологических сред, так и окружающей среды.
Экономический ущерб, нанесенного коррозионными разрушениями для предприятий нефтегазохимической промышленности, составляет около 50%. Это связано с влиянием на незащищенные поверхности металлоконструкций и оборудования, как агрессивных технологических сред, так и окружающей среды.
Но не только экономические потери влекут за собой коррозионные разрушения. Выход из строя оборудования в процессе его эксплуатации приводит к его разгерметизации и возгоранию, содержащихся в нем, технологических сред. Подобные возгорания в условиях современных производств, приводят к взрывам, уносящим за собой человеческие жизни. Последняя крупная авария на территории России, по причине коррозионного износа, произошла на Ачинском нефтеперерабатывающем заводе в 2014г, тогда погибло 8 человек.
Сегодня существует ряд методик и видов системной защиты металлов от столь нежелательного воздействия коррозии. Самым доступным и экономически оправданным способом защиты металла, является антикоррозионная защита на основе лакокрасочных покрытий.
В основе метода антикоррозонной защиты лежит принцип создании барьера между защищаемым металлом и агрессивной средой. Принимать во внимание следует не только агрессивные технологические среды, но и влияние окружающей среды (воздух и ультрафиолет).
Современные системы антикоррозионной защиты на основе лакокрасочных покрытий состоят из одного или двух видов лакокрасочных материалов, таких как: антикоррозионный грунт и антикоррозионная краска. Тип лакокрасочного материала и сочетание различных типов лакокрасочных покрытий определяются в соответствии с требованиями, предъявляемыми к системе антикоррозионной защиты.
К системе антикоррозионной защиты предъявляются следующие требования:
1. Предполагаемый срок службы;
2. Условия эксплуатации системы антикоррозионной защиты;
3. Условия нанесения;
4. Ремонтопригодность;
Ремонтопригодность;
В соответствии с вышеперечисленными требованиями подбирается материалы антикоррозионных покрытий, способных защитить поверхность металлоконструкций и технических устройств на срок до 25 лет, при условии соблюдения технологии нанесения лакокрасочных покрытий и проведения своевременного контроля нанесенных лакокрасочных материалов в процессе эксплуатации.
Условия эксплуатации материалов антикоррозионной защиты на основе лакокрасочных покрытий является важнейшим факторов определяющих предполагаемый срок службы системы. Условия эксплуатации определяются количеством и видом агрессивных компонентов, входящих в состав:
1. Технологической среды, воздействующей на внутренние поверхности сосудов и резервуаров;
2. Окружающей среды, воздействующей на наружные поверхности технических устройств, металлоконструкций и конструкций из бетона.
Технологические среды.
Технологические среды бывают следующими:
— нефть и нефтепродукты,
— кислоты,
— вода и газы.
Параметры технологической среды, категории ее коррозийной активности, а также соответствие требованиям технической документации на конкретный лакокрасочный материал, определяются компоненты системы антикоррозионной защиты.
Окружающая среда.
Окружающая среда подразделяется в соответствии с требованиями ИСО 12944-5 на шесть категорий атмосферной коррозионной активности от С1 до С5-М и
на три категории для воды и почвы от Im 1 до Im 3. ИСО 12944-5 рекомендует методику определения системы антикоррозионной защиты. Так же при выборе
систем антикоррозионной защиты учитываются требования технической документации на лакокрасочный материал, выбранный в качестве компонента системы.
Наряду с условиями эксплуатации систем антикоррозионной защиты, важнейшую роль в предполагаемом сроке службы
лакокрасочных покрытий играет и соблюдение технологии их нанесения.
В процессе выполнения работ по антикоррозионной защите необходимо производить следующие виды контроля:
1. Условия окружающей среды;
2. Входной контроль лакокрасочных материалов и абразива;
3. Подготовка поверхности передназначиной для окрашивания;
4. Подготовка лакокрасочных материалов для нанесения на окрашиваемую поверхность;
5. Нанесение антикоррозионного материала и его отверждение;
6. Качество готового покрытия.
Этап подготовки металлической поверхности перед нанесением первого слоя системы антикоррозионной защиты самый ответственный. С целью удаления продуктов коррозии, окалины, загрязнений и т.п. поверхность металла следует очистить. Так же предварительная обработка поверхности металла необходима для её активации. Исключать подготовительные работы нельзя! Иначе образование адгезионных связей между металлической поверхностью и лакокрасочным покрытием, так необходимых для полноценной работы антикоррозийных систем, станет невозможным.
Для классификации степени подготовки поверхности руководствуются требованиями ИСО 8501. Необходимая степень очистки металла индивидуальна для каждого применяемого лакокрасочного материала, и в полном объеме указанна в технической документации. Но как показывает практика только лишь степень абразивоструйной очистки Sa 2,5 (очень тщательная очистка, любые загрязнения выглядят, как не значительное окрашивание в виде пятен или полос) способна создать необходимое количество адгезионных связей для создания системы антикоррозионной защиты с предполагаемым сроком службы до 25 лет.
Контроль, над всеми этапами работ, необходимо производить в соответствии с требованиями ИСО стандартов. Работы по нанесению антикоррозионных красок и антикоррозионных грунтовок в соответствии технической документацией на используемые антикоррозионные материалы. Для объективной оценки, контроль над проведением работ, должен осуществлять независимый, от производителя работ, инспектор. Для создания качественной антикоррозионной защиты и правильного применения всех антикоррозийных систем на объекте, где проводится защита резервуаров, трубопроводов и т.п. присутствие аттестованного и независимого инспектора не вызывает сомнения. Является неотъемлемой частью процесса, и положительно сказывается на сроке службы инфраструктурных объектов.
Для создания качественной антикоррозионной защиты и правильного применения всех антикоррозийных систем на объекте, где проводится защита резервуаров, трубопроводов и т.п. присутствие аттестованного и независимого инспектора не вызывает сомнения. Является неотъемлемой частью процесса, и положительно сказывается на сроке службы инфраструктурных объектов.
Правильно подобранные лакокрасочные покрытия и выполнение всех требований по технологии их нанесения необходимо для создания систем антикоррозионного покрытия. Но увеличить предполагаемый срок службы системы антикоррозионной защиты до 25 лет может гарантировать только целостность покрытия на протяжении всего процесса эксплуатации.
В процессе эксплуатации неизбежно появление механических повреждений лакокрасочного покрытия, контроль за выявлениями которых необходим повсеместно. Незначительные механические повреждения, под влиянием окружающей среды, способны перерасти в дефекты покрытия в виде растрескивания и отслоения. Площадь таких дефектов будет многократно превышать размер исходного повреждения. Из вышесказанного следует, что ежегодная инспекция с целью выявления дефектов антикоррозионной защиты с последующим их устранением, является неотъемлемой частью производственного процесса на всех предприятиях.
На основании изложенного мы готовы предложить Вам лучшие технологии и решения, исходя из мирового и Российского опыта по подготовке поверхности, окраске, выбору оптимальных схем антикоррозионной защиты, как для объектов капитального строительства, так и для проведения ремонтных работ, которые позволят получить не только качественное лакокрасочное защитное покрытие с длительным сроком эксплуатации, но и сэкономить бюджетные средства.
Выезд нашего инспектора, на объект на время проведения покрасочных работ, является обязательным условием! Это позволяет обеспечить соблюдение технического регламента и дисциплинированному исполнению пожеланий заказчика. Только специально обученный сотрудник компании Jotun может обеспечить подобающий контроль за проведением всего комплекса работ по созданию высококачественной антикоррозионной защиты.
Только специально обученный сотрудник компании Jotun может обеспечить подобающий контроль за проведением всего комплекса работ по созданию высококачественной антикоррозионной защиты.
Соблюдение техники безопасности при производстве работ, входной контроль материалов, подготовительные этапы, контроль по соблюдению технологического регламента, оформление документации, сдача объекта – все это далеко не полный перечень обязательств возложенных на наших специалистов. Все технические инспектора имеют сертификаты «FROSIO» и «Прометей».
Разработка руководящего документа по антикоррозионной защите как металлических так и железобетонных конструкций, определяющий требования к материалам, подготовке поверхности, нанесению покрытия, ремонту, проверке и испытанию покрытий также входит в перечень наших услуг.
методов предотвращения коррозии | EonCoat
Методы предотвращения коррозии
Мы в EonCoat понимаем важность предотвращения коррозии. Ржавчина и другие формы коррозии могут привести к проблемам с безопасностью и нарушить целостность вашего оборудования и расходных материалов. Даже плановое обслуживание по удалению и устранению коррозии может привести к увеличению затрат. К счастью, есть ряд мер, которые можно предпринять, чтобы минимизировать коррозию. Здесь мы выделим четыре из этих методов с точки зрения затрат и эффективности.
1. Барьерные покрытия
Один из самых простых и дешевых способов предотвратить коррозию — использовать барьерные покрытия, такие как краска, пластик или порошок. Порошки, включая эпоксидную смолу, нейлон и уретан, нагреваются до металлической поверхности, образуя тонкую пленку. Пластик и воск часто распыляют на металлические поверхности. Краска действует как покрытие, защищающее металлическую поверхность от электрохимического заряда, исходящего от коррозионных соединений. Современные системы окраски на самом деле представляют собой комбинацию различных слоев краски, которые выполняют разные функции.Грунтовка действует как ингибитор, промежуточное покрытие увеличивает общую толщину краски, а завершающее покрытие обеспечивает устойчивость к факторам окружающей среды.
Современные системы окраски на самом деле представляют собой комбинацию различных слоев краски, которые выполняют разные функции.Грунтовка действует как ингибитор, промежуточное покрытие увеличивает общую толщину краски, а завершающее покрытие обеспечивает устойчивость к факторам окружающей среды.
Самый большой недостаток покрытий заключается в том, что их часто нужно снимать и наносить повторно. Неправильно нанесенные покрытия могут быстро выйти из строя и привести к повышенному уровню коррозии. Покрытия также могут содержать летучие органические соединения, которые могут сделать их уязвимыми для коррозии.
2. Горячее цинкование
Этот метод защиты от коррозии заключается в погружении стали в расплавленный цинк.Железо в стали вступает в реакцию с цинком, образуя прочно связанное покрытие из сплава, которое служит защитой. Этот процесс существует уже более 250 лет и используется для защиты от коррозии таких вещей, как художественные скульптуры и игровое оборудование. По сравнению с другими методами защиты от коррозии гальванизация известна более низкими начальными затратами, устойчивостью и универсальностью.
К сожалению, цинкование невозможно провести на месте, а это означает, что компаниям приходится снимать оборудование с работы для обработки.Некоторое оборудование может быть просто слишком большим для процесса, что вынуждает компании вообще отказываться от этой идеи. Кроме того, если процесс не будет выполнен должным образом, цинк может отслоиться или отслоиться. А высокое воздействие элементов окружающей среды может ускорить процесс износа цинка, что приведет к увеличению количества проверок при техническом обслуживании. Наконец, пары цинка, выделяющиеся в процессе цинкования, токсичны.
3. Легированная сталь (нержавеющая)
Легированная сталь — один из наиболее эффективных методов защиты от коррозии, сочетающий в себе свойства различных металлов для обеспечения дополнительной прочности и устойчивости получаемого продукта. Коррозионно-стойкий никель, например, в сочетании с стойким к окислению хромом дает сплав, который можно использовать в окисленных и восстановленных химических средах. Различные сплавы обеспечивают устойчивость к различным условиям, что дает компаниям большую гибкость.
Коррозионно-стойкий никель, например, в сочетании с стойким к окислению хромом дает сплав, который можно использовать в окисленных и восстановленных химических средах. Различные сплавы обеспечивают устойчивость к различным условиям, что дает компаниям большую гибкость.
Несмотря на свою эффективность, легированная сталь очень дорога. Компаниям с ограниченными финансовыми ресурсами, вероятно, придется обратиться к другим методам. Контроль состояния поверхности имеет решающее значение, поскольку трещины или царапины могут привести к усилению коррозии.Компаниям также необходимо убедиться, что используемые при техническом обслуживании средства не обладают коррозионными свойствами.
4. Катодная защита
Катодная защита защищает от гальванической коррозии, которая возникает, когда два разных металла соединяются и подвергаются воздействию коррозионного электролита. Чтобы предотвратить это, активные центры на поверхности металла необходимо преобразовать в пассивные за счет подачи электронов из другого источника, обычно с гальваническими анодами, прикрепленными на поверхности или рядом с ней.Металлы, используемые для анодов, включают алюминий, магний или цинк.
Хотя катодная защита очень эффективна, аноды необходимо часто проверять, что может увеличить расходы на техническое обслуживание. Они также увеличивают вес прикрепляемой конструкции и не всегда эффективны в средах с высоким удельным сопротивлением. Наконец, аноды приводят к увеличению расхода воды на кораблях и другом подводном оборудовании.
EonCoat, метод для вас
Выбрать подходящую защиту от коррозии для вашего оборудования непросто.У каждого из вышеперечисленных методов есть свои плюсы и минусы, и здесь на помощь приходит EonCoat. По сравнению с рентабельностью, отсутствием обслуживания и возможностью использования EonCoat на месте другие методы не могут конкурировать. EonCoat не использует токсичных химикатов и является экологически чистым. Наша 30-летняя гарантия гарантирует, что ваше оборудование останется защищенным дольше. Мы сделали ставку на то, чтобы предоставить лучший метод защиты от коррозии, чтобы помочь таким компаниям, как ваша, двигаться вместе с минимальными хлопотами. Нет причин не воспользоваться преимуществами EonCoat сегодня.
Мы сделали ставку на то, чтобы предоставить лучший метод защиты от коррозии, чтобы помочь таким компаниям, как ваша, двигаться вместе с минимальными хлопотами. Нет причин не воспользоваться преимуществами EonCoat сегодня.
Как предотвратить коррозию | Металлические супермаркеты
Что такое коррозия?
Коррозия — это порча материала, вызванная взаимодействием с окружающей средой. Это естественное явление, требующее трех условий: влажность, металлическая поверхность и окислитель, известный как акцептор электронов. В процессе коррозии поверхность химически активного металла преобразуется в более стабильную форму, а именно в его оксид, гидроксид или сульфид. Распространенная форма коррозии — ржавчина.
Коррозия может оказывать на металл множество негативных воздействий.Когда металлические конструкции подвергаются коррозии, они становятся небезопасными, что может привести к несчастным случаям, например, обрушениям. Даже незначительная коррозия требует ремонта и обслуживания. Фактически, ежегодные прямые затраты на коррозию металлов во всем мире составляют примерно 2,2 триллиона долларов США!
Хотя все металлы подвержены коррозии, по оценкам, 25-30% коррозии можно предотвратить с помощью подходящих методов защиты.
Как предотвратить коррозию
Вы можете предотвратить коррозию, выбрав правильный:
- Металл Тип
- Защитное покрытие
- Меры по охране окружающей среды
- Жертвенные покрытия
- Ингибиторы коррозии
- Модификация конструкции
Металл Тип
Один из простых способов предотвратить коррозию — использовать коррозионно-стойкий металл, например алюминий или нержавеющую сталь.В зависимости от области применения эти металлы могут использоваться для уменьшения потребности в дополнительной защите от коррозии.
Защитные покрытия
Нанесение лакокрасочного покрытия — экономичный способ предотвращения коррозии. Покрытия краски действуют как барьер, предотвращающий передачу электрохимического заряда от коррозионного раствора к металлу под ним.
Покрытия краски действуют как барьер, предотвращающий передачу электрохимического заряда от коррозионного раствора к металлу под ним.
Другая возможность — нанесение порошкового покрытия. В этом процессе на чистую металлическую поверхность наносится сухой порошок.Затем металл нагревается, в результате чего порошок расплавляется в гладкую непрерывную пленку. Можно использовать ряд различных порошковых композиций, включая акрил, полиэфир, эпоксидную смолу, нейлон и уретан.
Меры по охране окружающей среды
Коррозия вызывается химической реакцией между металлом и газами в окружающей среде. Эти нежелательные реакции можно свести к минимуму, приняв меры по контролю за окружающей средой. Это может быть как простое уменьшение воздействия дождя или морской воды, так и более сложные меры, такие как контроль количества серы, хлора или кислорода в окружающей среде.Примером этого может быть обработка воды в водогрейных котлах умягчителями для регулирования жесткости, щелочности или содержания кислорода.
Жертвенные покрытия
Жертвенное покрытие включает покрытие металла дополнительным типом металла, который более склонен к окислению; отсюда и термин «жертвенное покрытие».
Существует два основных метода получения защитного покрытия: катодная защита и анодная защита.
Катодная защита
Наиболее распространенным примером катодной защиты является нанесение цинка на сталь, легированную железом, — процесс, известный как гальваника.Цинк — более активный металл, чем сталь, и когда он начинает разъедать, он окисляется, что замедляет коррозию стали. Этот метод известен как катодная защита, потому что он работает, делая сталь катодом электрохимической ячейки. Катодная защита используется для стальных трубопроводов, транспортирующих воду или топливо, резервуаров для водонагревателей, корпусов судов и морских нефтяных платформ.
Анодная защита
Анодная защита включает покрытие стали, легированной железом, менее активным металлом, например оловом. Олово не подвергается коррозии, поэтому сталь будет защищена, пока остается оловянное покрытие. Этот метод известен как анодная защита, потому что он делает сталь анодом электрохимической ячейки.
Олово не подвергается коррозии, поэтому сталь будет защищена, пока остается оловянное покрытие. Этот метод известен как анодная защита, потому что он делает сталь анодом электрохимической ячейки.
Анодная защита часто применяется для резервуаров из углеродистой стали, используемых для хранения серной кислоты и 50% каустической соды. В этих средах катодная защита не подходит из-за чрезвычайно высоких требований к току.
Ингибиторы коррозии
Ингибиторы коррозии — это химические вещества, которые вступают в реакцию с поверхностью металла или окружающими газами для подавления электрохимических реакций, ведущих к коррозии.Они работают, будучи нанесенными на поверхность металла, где образуют защитную пленку. Ингибиторы можно наносить в виде раствора или в виде защитного покрытия с использованием методов диспергирования. Ингибиторы коррозии обычно применяются с помощью процесса, известного как пассивация.
Пассивация
При пассивации легкий слой защитного материала, такого как оксид металла, создает защитный слой поверх металла, который действует как барьер против коррозии. На формирование этого слоя влияют pH окружающей среды, температура и химический состав окружающей среды.Ярким примером пассивации является Статуя Свободы, где образовалась сине-зеленая патина, которая фактически защищает медь под ней. Ингибиторы коррозии используются в нефтепереработке, химическом производстве и водоочистных сооружениях.
Модификация конструкции
Изменения конструкции могут помочь уменьшить коррозию и повысить долговечность любых существующих защитных антикоррозионных покрытий. В идеале конструкции не должны улавливать пыль и воду, поощрять движение воздуха и избегать открытых щелей.Обеспечение доступности металла для регулярного обслуживания также увеличит срок службы.
Metal Supermarkets — крупнейший в мире поставщик мелкосерийного металла с более чем 85 магазинами в США, Канаде и Великобритании. Мы эксперты по металлу и обеспечиваем качественное обслуживание клиентов и продукцию с 1985 года.
Мы эксперты по металлу и обеспечиваем качественное обслуживание клиентов и продукцию с 1985 года.
В Metal Supermarkets мы поставляем широкий ассортимент металлов для различных областей применения. В нашем ассортименте: нержавеющая сталь, легированная сталь, оцинкованная сталь, инструментальная сталь, алюминий, латунь, бронза и медь.
Наша горячекатаная и холоднокатаная сталь доступна в широком диапазоне форм, включая пруток, трубы, листы и пластины. Мы можем разрезать металл в точном соответствии с вашими требованиями.
Посетите одно из наших 80+ офисов в Северной Америке сегодня.
Предотвращение коррозии | Введение в химию
Цель обучения
- Обсудите общие профилактические меры, которые можно предпринять против коррозии металлической поверхности
Ключевые моменты
- Для возникновения коррозии необходимы три вещи: электролит, открытая металлическая поверхность и акцептор электронов.
- Коррозию можно предотвратить, сняв одно из этих условий.
- Покрытие металлической поверхности краской или эмалью создает барьер между металлом и влагой окружающей среды.
- Процесс покрытия металлической поверхности другим металлом, который с большей вероятностью окисляется, называется жертвенным покрытием.
Условия
- жертвенное покрытие Металлическое покрытие, которое подвержено окислению с большей вероятностью, чем металл, который оно защищает.
- цинкование Для покрытия тонким слоем металла электрохимическим способом; к гальванике.
- электролит: Вещество, которое в растворе или в расплавленном состоянии ионизирует и проводит электричество.
Анализ коррозии
Мы узнали, что для анодной и катодной стадий коррозии необходимы три вещи: электролит, открытая металлическая поверхность и акцептор электронов. Отсюда следует, что мы можем предотвратить коррозию, удалив одно из этих важных условий. Самое простое условие для удаления — это оголенная металлическая поверхность.
Самое простое условие для удаления — это оголенная металлическая поверхность.
Создание физического барьера
Покрытие металлической поверхности краской или эмалью создает барьер между металлом и влагой в окружающей среде, тем самым устраняя возможность контакта кислорода и влаги с металлом.
Жертвенные покрытия
Процесс покрытия металлической поверхности другим металлом, который с большей вероятностью окисляется, называется жертвенным покрытием.Сталь из сплава железа, подверженная коррозии, обычно покрывается цинком, более активным металлом, в процессе, известном как цинкование. Коррозия жертвенного цинка приводит к его окислению; железо восстанавливается, что делает его катодным и препятствует его коррозии.
Оцинкованная поверхность Защита сплавов железа покрытием из более активного металла посредством процесса цинкования предотвращает коррозию сплавов.Контраст с предыдущим сценарием можно увидеть, когда железо или железный сплав покрывают менее активным металлом, например оловом.Пока оловянное покрытие остается неповрежденным, коррозия невозможна. Однако, если оловянное покрытие ухудшится, обнажая лежащий под ним металл, произойдет коррозия. Это связано с тем, что обнаженное железо подвергается окислению и становится анодным. Олово принимает электроны от окисленного железа, и соблюдаются три критерия коррозии.
Катодная защита
Еще один способ защиты от коррозии — создание постоянного отрицательного электрического заряда на металле. Этот метод называется катодной защитой.Катодная защита воспроизводит эффект жертвенного покрытия, но с более активным металлом. Источником отрицательного заряда обычно является внешний источник постоянного тока. Катодная защита используется, в частности, для защиты подземных топливных баков и трубопроводов.
Пассивация
Пассивация — это процесс, при котором на металлической поверхности образуется тонкая пленка продуктов коррозии, служащая барьером против окисления. На формирование пассивирующего слоя влияют pH окружающей среды, температура и химические условия.Статуя Свободы, например, покрыта сине-зеленой патиной, вызванной несколькими химическими реакциями, которая защищает металлическую медь под ней.
На формирование пассивирующего слоя влияют pH окружающей среды, температура и химические условия.Статуя Свободы, например, покрыта сине-зеленой патиной, вызванной несколькими химическими реакциями, которая защищает металлическую медь под ней.
Анодирование
Анодирование — это еще одна обработка поверхности, защищающая от коррозии. Защищаемый металл покрывается специальным веществом, а электрохимические условия регулируются таким образом, чтобы в оксидной пленке металла появлялись однородные поры шириной несколько нанометров. Эти поры позволяют образовываться оксидной пленке, более толстой, чем пассивирующий слой.Полученный защитный слой очень твердый и очень эластичный.
Жертвенная защита анода
По тому же принципу, что и временное пленочное покрытие, расходуемый анод, сделанный из металла, более активного, чем металл, который вы хотите защитить, можно использовать для предотвращения коррозии металлических конструкций, погруженных в воду или заглубленных в землю. Жертвенный анод подвергнется коррозии раньше, чем металл, который он защищает. Однако, как только расходуемый анод подвергнется коррозии, его необходимо заменить; в противном случае металл, который она защищает, тоже начнет разъедать.
Катодная защита предотвращает коррозию Гальванический расходный анод, прикрепленный к корпусу корабля; Здесь протекторный анод показывает коррозию, а металл, к которому он прикреплен, — нет. Анод, кусок более электрохимически «активного» металла, прикреплен к уязвимой поверхности металла, где он подвергается воздействию электролита; потенциал уязвимой поверхности поляризован, чтобы быть более отрицательным, пока поверхность не будет иметь однородный потенциал. На этом этапе устраняется движущая сила реакции коррозии с защищаемой поверхностью.Гальванический анод продолжает корродировать, расходуя материал анода, пока в конечном итоге его не нужно будет заменить, но катодный материал защищен. Коррозия представляет реальную угрозу целостности личного имущества, а также мостов, дорог и другой общественной инфраструктуры. Понимание и реализация стратегий предотвращения коррозии уменьшит как экономический ущерб, так и ущерб, связанный с безопасностью, связанный с процессом.
Понимание и реализация стратегий предотвращения коррозии уменьшит как экономический ущерб, так и ущерб, связанный с безопасностью, связанный с процессом.
Показать источники
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
Методы, советы и решения для остановки и предотвращения коррозии металлов Упрочнение композитов
Методы остановки и предотвращения коррозии металлов
Коррозия металла возникает, когда металл подвергается воздействию влаги и других элементов или химикатов. Хотя это, как правило, естественный процесс, он может привести к серьезному снижению функциональности и эстетики металлических изделий.Какой бы ни была причина вашего желания остановить и предотвратить коррозию металлов, вот несколько полезных способов предотвращения коррозии металлов :
- Перейдите на неагрессивные металлы, такие как алюминий и нержавеющая сталь.
- Следите за тем, чтобы область вокруг металлической поверхности была сухой.
- Используйте осушители и влагонепроницаемые продукты.
- Убедитесь, что подземные трубопроводы проложены в слое засыпки, например, известняка.
- Регулярно очищайте электрические компоненты.
Следование этим простым шагам может продлить жизнь металлу, а остановит коррозию металлов на их следах.Имейте в виду, что весь металл требует ухода. Используйте эти методы часто, чтобы предотвратить коррозию металлов .
Дополнительные способы предотвращения коррозии металла
Помимо вышеперечисленных предложений, существуют методы обработки металла, которые могут остановить коррозию металлов до того, как она начнется; например, покрытие из консистентной смазки или масла на металлической поверхности. Покраска — еще один метод предотвращения коррозии металла. Также рассмотрите возможность использования катодной защиты для предотвращения коррозии основных металлических деталей.
Также рассмотрите возможность использования катодной защиты для предотвращения коррозии основных металлических деталей.
Покрытие из углеродного волокна для предотвращения коррозии металла
Покрытие из углеродного волокна — еще один отличный метод предотвращения коррозии металлов . В этом процессе листы углеродного волокна герметизируются вокруг и часто внутри металлической трубы или на любой металлической поверхности. Это не только помогает предотвратить коррозию, но и укрепляет металл, предотвращает образование трещин и предотвращает образование утечек.
Компания HJ3 Composite Technologies, предлагающая несколько продуктов и методов для предотвращения коррозии металлов, является авторитетом в области нанесения покрытий из углеродного волокна.Если вас беспокоит состояние вашего металла, позвоните нам сегодня.
5 способов предотвращения коррозии металлических деталей
Ни один металл не является полностью защищенным от угрозы коррозии. Но можно замедлить, контролировать или остановить коррозию до того, как она вызовет проблему.
Существуют практические способы предотвращения коррозии металлических деталей. Инженеры могут включить контроль коррозии в процесс проектирования.Производители могут применять защитные барьеры от коррозии. Наконец, люди, использующие деталь, могут предпринять профилактические меры, чтобы продлить срок ее службы.
Запросить цену
Что такое коррозия?
Коррозия возникает, когда металл вступает в реакцию с окислителем в окружающей его среде. Эта химическая реакция может привести к разрушению металла со временем, потускнению его внешнего вида и нарушению его структурной целостности.
Каждый тип металла имеет разные электрохимические свойства.Эти свойства определяют типы коррозии, которой подвержена деталь. Например, железные инструменты подвержены ржавчине от длительного воздействия влаги, а медная крыша потускнеет под воздействием погоды. Хотя некоторые металлы лучше сопротивляются коррозии, чем другие (в зависимости от окружающей среды), ни один из них не свободен от всех типов коррозии.
Хотя некоторые металлы лучше сопротивляются коррозии, чем другие (в зависимости от окружающей среды), ни один из них не свободен от всех типов коррозии.
Не существует универсального решения для предотвращения коррозии металлических деталей. С таким количеством типов металлов и тысячами возможных применений производители должны использовать различные методы для предотвращения и контроля коррозии в различных металлах.
Способы предотвращения коррозии металлических деталей
Предотвращение коррозии металлических деталей учитывается на всех этапах технологического процесса, от проектирования и изготовления до отделки и обслуживания.
Запросить цену
1. Конструкция
Контроль коррозии начинается еще на стадии проектирования. Если деталь предназначена для использования в среде, подверженной коррозии, производители должны проектировать деталь с учетом этого.
Например, части, подверженные воздействию элементов, должны позволять воде и мусору стекать, а не собираться на поверхности. Чтобы уменьшить щелевую коррозию, проектировщики должны устранить узкие зазоры, которые позволяют воздуху или жидкости проникать и застаиваться. Для агрессивных сред, например, в соленой воде, может быть разумно спроектировать некоторый допуск на коррозию.
2. Защитное покрытие
Покрытиямогут обеспечить слой защиты от коррозии, действуя как физический барьер между металлическими частями и окисляющими элементами в окружающей среде.Один из распространенных методов — гальванизация, при которой производители покрывают деталь тонким слоем цинка.
Порошковые покрытия — еще один эффективный способ предотвращения коррозии металлических деталей. При правильном применении порошковое покрытие может изолировать поверхность детали от окружающей среды для защиты от коррозии.
3. Экологический контроль
Многие факторы окружающей среды влияют на вероятность коррозии. Это помогает хранить металлические части в чистом и сухом месте, когда они не используются.Если вы собираетесь хранить их в течение длительного времени, подумайте об использовании методов контроля уровня серы, хлорида или кислорода в окружающей среде.
Это помогает хранить металлические части в чистом и сухом месте, когда они не используются.Если вы собираетесь хранить их в течение длительного времени, подумайте об использовании методов контроля уровня серы, хлорида или кислорода в окружающей среде.
Гальваническая коррозия возникает, когда металлические детали с двумя разными потенциалами электрода находятся в контакте с электролитом, таким как соленая вода. Это вызывает коррозию металла с более высокой активностью электрода в точке контакта. Можно предотвратить гальваническую коррозию, если хранить эти детали отдельно. Этот эффект также может работать как антикоррозионная мера, как описано ниже.
Запросить цену
4. Катодная защита
Можно предотвратить коррозию, подавая на поверхность металла противоположный электрический ток. Один из методов катодной защиты — это приложенный ток, использующий внешнее прохождение электрического тока для подавления коррозионного тока в детали.
Менее сложным методом катодной защиты от коррозии является использование расходуемого анода.Это включает в себя прикрепление небольшого реактивного металла к детали, которую вы хотите защитить. Ионы металла будут течь от химически активного металла к менее активной части, уменьшая коррозию за счет меньшей части.
5. Техническое обслуживание
Защитные покрытия, контроль окружающей среды и катодная защита — эффективные способы предотвращения коррозии металлических деталей. Однако эти меры ничто без постоянного обслуживания и мониторинга. Покрытия могут со временем изнашиваться; даже небольшие зазубрины и царапины могут привести к коррозии.Обязательно содержите детали в чистоте и при необходимости применяйте дополнительную защиту.
17.5: Коррозия и ее предотвращение
Задачи обучения
- Чтобы понять процесс коррозии.
Коррозия — это гальванический процесс, при котором металлы разрушаются в результате окисления — обычно, но не всегда, до их оксидов. Например, при воздействии воздуха ржавчина железа, потускнение серебра, а также медь и латунь приобретают голубовато-зеленую поверхность, называемую патиной.Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, 100 миллиардов долларов в год тратятся только в Соединенных Штатах на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии является очень активной областью промышленных исследований. В этом разделе мы описываем некоторые химические и электрохимические процессы, вызывающие коррозию. Мы также исследуем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Например, при воздействии воздуха ржавчина железа, потускнение серебра, а также медь и латунь приобретают голубовато-зеленую поверхность, называемую патиной.Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, 100 миллиардов долларов в год тратятся только в Соединенных Штатах на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии является очень активной областью промышленных исследований. В этом разделе мы описываем некоторые химические и электрохимические процессы, вызывающие коррозию. Мы также исследуем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Коррозия — это РЕДОКС-процесс.
В условиях окружающей среды окисление большинства металлов является термодинамически самопроизвольным, за исключением золота и платины. Поэтому на самом деле несколько удивительно, что какие-либо металлы вообще полезны во влажной, богатой кислородом атмосфере Земли. Однако некоторые металлы устойчивы к коррозии по кинетическим причинам. Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение.Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали отличаются высокой устойчивостью к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
В отличие от этих металлов, когда железо корродирует, оно образует красно-коричневый гидратированный оксид металла (Fe 2 O 3 • x H 2 O), широко известный как ржавчина, который не вызывает коррозии. плотная защитная пленка (рисунок \ (\ PageIndex {1} \)).Вместо этого ржавчина постоянно отслаивается, обнажая поверхность свежего металла, уязвимую для реакции с кислородом и водой. Поскольку для образования ржавчины требуются кислород и вода, железный гвоздь, погруженный в деоксигенированную воду, не ржавеет даже в течение нескольких недель. Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, насыщенное кислородом, не будет ржаветь из-за отсутствия воды.
Рисунок \ (\ PageIndex {1} \): Ржавчина, результат коррозии металлического железа.Железо окисляется до Fe 2 + (водн.) На анодном участке на поверхности железа, который часто является примесью или дефектом решетки. Кислород восстанавливается до воды в другом месте на поверхности железа, которое действует как катод. Электроны передаются от анода к катоду через электропроводящий металл. Вода является растворителем для Fe 2 + , который образуется изначально и действует как солевой мостик. Ржавчина (Fe 2 O 3 • xH 2 O) образуется в результате последующего окисления Fe 2 + кислородом воздуха.+ _ {(aq)} \ label {Eq4} \]Знак и величина E ° для процесса коррозии (Уравнение \ (\ ref {Eq3} \)) указывают на то, что существует сильная движущая сила для окисления железа O 2 при стандартных условиях (1 MH + ). В нейтральных условиях движущая сила несколько меньше, но все же заметна (E = 1,25 В при pH 7,0). Обычно реакция атмосферного CO 2 с водой с образованием H + и HCO 3 — обеспечивает достаточно низкий pH для увеличения скорости реакции, как и кислотный дождь.Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с основным металлом. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две относительно удаленные друг от друга царапины могут работать вместе как анод и катод, что приводит к внезапному механическому отказу (Рисунок \ (\ PageIndex { 2} \)).
Рисунок \ (\ PageIndex {2} \): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности при большем контакте с воздухом (катод), в то время как металлическое железо окисляется до Fe 2 + (водн.) На менее незащищенном участке (анод). Ржавчина образуется, когда Fe 2 + (водный) диффундирует в место, где он может реагировать с атмосферным кислородом, который часто находится далеко от анода.Электрохимическое взаимодействие между катодным и анодным участками может вызвать образование большой ямы под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о том, что произошла коррозия.Профилактическая защита
Одним из наиболее распространенных методов предотвращения коррозии железа является нанесение защитного покрытия из другого металла, который труднее окисляется. Например, смесители и некоторые внешние детали автомобилей часто покрываются тонким слоем хрома с помощью электролитического процесса.Однако с увеличением использования полимерных материалов в автомобилях использование хромированной стали в последние годы сократилось. Точно так же «жестяные банки», в которых хранятся супы и другие продукты, на самом деле сделаны из стали, покрытой тонким слоем олова. Ни хром, ни олово по своей природе не устойчивы к коррозии, но оба образуют защитные оксидные покрытия.
Рисунок \ (\ PageIndex {3} \): Гальваническая коррозия. Если железо контактирует с более стойким к коррозии металлом, таким как олово, медь или свинец, другой металл может действовать как большой катод, что значительно увеличивает скорость восстановления кислорода.Поскольку восстановление кислорода связано с окислением железа, это может привести к резкому увеличению скорости окисления железа на аноде. Гальваническая коррозия может возникнуть, когда два разнородных металла соединены напрямую, что позволяет электронам переноситься от одного к другому.Как и в случае с защитной краской, царапины на защитном металлическом покрытии могут вызвать коррозию. Однако в этом случае присутствие второго металла может фактически увеличить скорость коррозии.Значения стандартных электродных потенциалов для Sn 2 + (E ° = -0,14 В) и Fe 2 + (E ° = -0,45 В) в таблице P2 показывают, что Fe окисляется легче, чем Sn. В результате более стойкий к коррозии металл (в данном случае олово) ускоряет коррозию железа, действуя как катод и обеспечивая большую площадь поверхности для восстановления кислорода (рисунок \ (\ PageIndex {3} \)). . Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом.Менее легко окисляемая медь действует как катод, заставляя железо быстро растворяться возле соединения и иногда приводя к катастрофическому отказу водопровода.
Катодная защита
Один из способов избежать этих проблем — использовать более легко окисляемый металл для защиты железа от коррозии. В этом подходе, называемом катодной защитой, более реактивный металл, такой как Zn (E ° = -0,76 В для Zn 2 + + 2e — → Zn), становится анодом, а железо становится катодом.{2 +} _ {(aq)} + 2H_2O _ {(l)}} _ {\ text {total}} \ label {Eq7} \]
Более химически активный металл вступает в реакцию с кислородом и в конечном итоге растворяется, «жертвуя собой» ради защиты железного предмета. Катодная защита — это принцип, лежащий в основе оцинкованной стали, которая представляет собой сталь, защищенную тонким слоем цинка. Оцинкованная сталь используется в различных предметах, от гвоздей до мусорных баков.
Кристаллическая поверхность горячеоцинкованной стальной поверхности. Это служило как профилактической защитой (защищая нижележащую сталь от кислорода в воздухе), так и катодной защитой (после воздействия цинк окисляется раньше, чем нижележащая сталь).В аналогичной стратегии расходуемых электродов , использующих, например, магний, используются для защиты подземных резервуаров или трубопроводов (Рисунок \ (\ PageIndex {4} \)). Замена расходуемых электродов более рентабельна, чем замена железных предметов, которые они защищают.
Рисунок \ (\ PageIndex {4} \): Использование жертвенного электрода для защиты от коррозии. Присоединение магниевого стержня к подземному стальному трубопроводу защищает трубопровод от коррозии. Поскольку магний (E ° = −2.37 В) окисляется гораздо легче, чем железо (E ° = -0,45 В), стержень из магния действует как анод в гальваническом элементе. Таким образом, трубопровод вынужден действовать как катод, на котором восстанавливается кислород. Грунт между анодом и катодом действует как солевой мостик, замыкающий электрическую цепь и поддерживающий электрическую нейтральность. Когда Mg (ы) окисляется до Mg 2 + на аноде, анионы в почве, такие как нитрат, диффундируют к аноду, чтобы нейтрализовать положительный заряд. Одновременно катионы в почве, такие как H + или NH 4 + , диффундируют к катоду, где они пополняют запас протонов, которые расходуются по мере восстановления кислорода.Аналогичная стратегия использует много миль несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.Пример \ (\ PageIndex {1} \)
Предположим, старый деревянный парусник, скрепленный железными винтами, имеет бронзовый гребной винт (напомним, что бронза — это сплав меди, содержащий около 7-10% олова).
- Если лодка погрузится в морскую воду, какая реакция коррозии произойдет? Что такое E ° ячейка ?
- Как можно предотвратить возникновение этой коррозии?
Дано: идентичность металлов
Запрошено: реакция коррозии, E ° ячейка и профилактические меры
Стратегия:
- Запишите реакции, которые происходят на аноде и катоде.Из них запишите общую реакцию клетки и вычислите E ° , ячейку .
- Предложите возможные профилактические меры на основании относительной окислительно-восстановительной активности различных веществ.
Решение
- A Согласно таблице P2, и медь, и олово являются менее активными металлами, чем железо (т. Е. Они имеют более высокие положительные значения E °, чем железо). Таким образом, если олово или медь вступят в электрический контакт морской водой с железом в присутствии кислорода, произойдет коррозия.\ circ _ {\ textrm {total}} = \ textrm {1,68 V}
\ end {align} \)Со временем железные винты растворятся, и лодка развалится.
- B Возможные способы предотвращения коррозии в порядке уменьшения стоимости и неудобств: разборка лодки и ее восстановление с помощью бронзовых винтов; вынуть лодку из воды и хранить в сухом месте; или прикрепление недорогого металлического цинка к карданному валу в качестве расходуемого электрода и его замену один или два раза в год.Поскольку цинк является более активным металлом, чем железо, он будет действовать как расходуемый анод в электрохимической ячейке и растворяться (уравнение \ (\ ref {Eq7} \)).
Упражнение \ (\ PageIndex {1} \)
Предположим, что водопроводные трубы, ведущие в ваш дом, сделаны из свинца, а остальная сантехника в вашем доме — из железа.Чтобы исключить возможность отравления свинцом, вы вызываете сантехника для замены свинцовых труб. Он называет вам очень низкую цену, если он сможет использовать имеющиеся у него запасы медных труб для выполнения этой работы.
- Вы принимаете его предложение?
- Чем еще должен заниматься сантехник у вас дома?
- Ответьте на
-
Нет, если вы не планируете в ближайшее время продать дом, потому что соединения труб Cu / Fe приведут к быстрой коррозии.
- Ответьте на
-
Любые существующие соединения Pb / Fe должны быть тщательно проверены на предмет коррозии железных труб из-за соединения Pb-Fe; менее активный Pb будет служить катодом для восстановления O 2 , способствуя окислению более активного Fe поблизости.
Сводка
Коррозия — это гальванический процесс, который можно предотвратить с помощью катодной защиты. Разрушение металлов в результате окисления — это гальванический процесс, называемый коррозией.Защитные покрытия состоят из второго металла, который окисляется труднее, чем защищаемый металл. В качестве альтернативы, на металлическую поверхность можно нанести более легко окисляемый металл, тем самым обеспечивая катодную защиту поверхности. Тонкий слой цинка защищает оцинкованную сталь. Жертвенные электроды также могут быть прикреплены к объекту для его защиты.
17.6 Коррозия — химия
Цели обучения
К концу этого раздела вы сможете:
- Определить коррозию
- Перечислите некоторые методы, используемые для предотвращения или замедления коррозии.
Коррозия обычно определяется как разложение металлов в результате электрохимического процесса.Образование ржавчины на железе, потускнение серебра и сине-зеленая патина на меди — все это примеры коррозии. Общие затраты на коррозию в Соединенных Штатах значительны и оцениваются более чем в полтриллиона долларов в год.
Статуя Свободы: меняя цвета
Статуя Свободы — достопримечательность, которую признает каждый американец. Статую Свободы легко узнать по ее высоте, положению и уникальному сине-зеленому цвету (рис. 1). Когда эта статуя впервые была доставлена из Франции, она не имела зеленого цвета.Оно было коричневым, цвета его медной «кожи». Так как же Статуя Свободы изменила цвет? Изменение внешнего вида было прямым результатом коррозии. Медь, которая является основным компонентом статуи, медленно подвергалась окислению на воздухе. Окислительно-восстановительные реакции металлической меди в окружающей среде протекают в несколько стадий. Металлическая медь окисляется до оксида меди (I) (Cu 2 O), который имеет красный цвет, а затем до оксида меди (II), который имеет черный цвет
.[латекс] \ begin {array} {r @ {{} \ longrightarrow {}} ll} 2 \ text {Cu} (s) \; + \; \ frac {1} {2} \ text {O} _2 (g) & \ text {Cu} _2 \ text {O} (s) & (\ text {red}) \\ [0.5em] \ text {Cu} _2 \ text {O} (s) \; + \; \ frac {1} {2} \ text {O} _2 (g) & 2 \ text {CuO} (s) & ( \ text {черный}) \ end {array} [/ latex]
Уголь, часто содержащий большое количество серы, активно сжигался в начале прошлого века. В результате триоксид серы, диоксид углерода и вода реагировали с CuO
.[латекс] \ begin {array} {r @ {{} = {}} ll} 2 \ text {CuO} (s) \; + \; \ text {CO} _2 (g) \; + \; \ текст {H} _2 \ text {O} (l) & \ text {Cu} _2 \ text {CO} _3 (\ text {OH}) _ 2 (s) & (\ text {зеленый}) \\ [0.5em ] 3 \ text {CuO} (s) \; + \; 2 \ text {CO} _2 (g) \; + \; \ text {H} _2 \ text {O} (l) & \ text {Cu} _2 (\ text {CO} _3) _2 (\ text {OH}) _ 2 (s) & (\ text {blue}) \\ [0.5em] 4 \ text {CuO} (s) \; + \; \ text {SO} _3 (g) \; + \; 3 \ text {H} _2 \ text {O} (l) & \ text {Cu } _4 \ text {SO} _4 (\ text {OH}) _ 6 (s) & (\ text {green}) \ end {array} [/ latex]
Эти три соединения ответственны за характерную сине-зеленую патину, наблюдаемую сегодня. К счастью, патина создала защитный слой на поверхности, предотвращающий дальнейшую коррозию медной пленки. Формирование защитного слоя — это форма пассивации, которая обсуждается далее в следующей главе.
Рисунок 1. (a) Статуя Свободы покрыта медной кожей и изначально была коричневой, как показано на этой картине. (б) Воздействие элементов привело к образованию сине-зеленой патины, наблюдаемой сегодня.Пожалуй, самый известный пример коррозии — образование ржавчины на железе. {\ circ} = -0.{+} (водн.) [/ латекс]
Количество молекул воды варьируется, поэтому оно представлено как x . В отличие от патины на меди, образование ржавчины не создает защитного слоя, поэтому коррозия железа продолжается, поскольку ржавчина отслаивается и подвергает свежее железо воздействию атмосферы.
Рис. 2. Как только краска поцарапана на окрашенной железной поверхности, возникает коррозия и начинает образовываться ржавчина. Скорость самопроизвольной реакции увеличивается в присутствии электролитов, таких как хлорид натрия, используемый на дорогах для таяния льда и снега или в соленой воде.Один из способов уберечь железо от коррозии — это держать его в краске. Слой краски предотвращает попадание воды и кислорода, необходимых для образования ржавчины, на утюг. Пока краска остается неповрежденной, утюг защищен от коррозии.
Другие стратегии включают сплавление железа с другими металлами. Например, нержавеющая сталь — это в основном железо с небольшим содержанием хрома. Хром имеет тенденцию собираться у поверхности, где он образует оксидный слой, защищающий железо.
Оцинкованное железо или оцинкованное железо использует другую стратегию. Цинк окисляется легче, чем железо, потому что цинк имеет более низкий восстановительный потенциал. Поскольку цинк имеет более низкий восстановительный потенциал, это более активный металл. Таким образом, даже если цинковое покрытие поцарапано, цинк все равно будет окисляться раньше железа. Это говорит о том, что этот подход должен работать с другими активными металлами.
Еще один важный способ защиты металла — это сделать его катодом в гальваническом элементе.Это катодная защита и может использоваться не только для железа, но и для других металлов. Например, ржавление подземных резервуаров для хранения железа и труб можно предотвратить или значительно уменьшить, подключив их к более активному металлу, такому как цинк или магний (рис. 3). Это также используется для защиты металлических частей водонагревателей. Более активные металлы (более низкий потенциал восстановления) называются расходуемыми анодами , потому что по мере их использования они коррозируют (окисляются) на аноде.Защищаемый металл служит катодом и поэтому не окисляется (не корродирует). Когда аноды подвергаются надлежащему контролю и периодически заменяются, полезный срок службы резервуара для хранения железа может быть значительно увеличен.
Рисунок 3. Одним из способов защиты подземного резервуара для хранения железа является катодная защита. Использование в качестве анода активного металла, такого как цинк или магний, эффективно превращает резервуар для хранения в катод, предотвращая его коррозию (окисление).Коррозия — это разрушение металла, вызванное электрохимическим процессом.Ежегодно тратятся большие суммы денег на устранение последствий или предотвращение коррозии. Некоторые металлы, такие как алюминий и медь, образуют защитный слой при коррозии на воздухе. Тонкий слой, который образуется на поверхности металла, предотвращает контакт кислорода с большим количеством атомов металла и, таким образом, «защищает» оставшийся металл от дальнейшей коррозии. Железо разъедает (образует ржавчину) под воздействием воды и кислорода. Ржавчина, образующаяся на металлическом железе, отслаивается, обнажая свежий металл, который также подвергается коррозии.Один из способов предотвратить или замедлить коррозию — нанести на металл покрытие. Покрытие предотвращает контакт воды и кислорода с металлом. Краска или другие покрытия замедляют коррозию, но они неэффективны после царапин. Оцинкованное или оцинкованное железо использует тот факт, что цинк более склонен к окислению, чем железо. Пока покрытие остается, даже если оно поцарапано, цинк будет окисляться раньше железа. Еще один метод защиты металлов — катодная защита. В этом методе легко окисляемый и недорогой металл, часто цинк или магний (расходуемый анод), электрически соединяется с металлом, который необходимо защищать.Более активный металл — это расходуемый анод, который является анодом в гальванической ячейке. «Защищенный» металл — это катод, и он остается неокисленным. Одним из преимуществ катодной защиты является то, что расходуемый анод можно контролировать и при необходимости заменять.
Химия: упражнения в конце главы
- Какой элемент каждой пары металлов более подвержен коррозии (окислению)?
(а) Mg или Ca
(б) Au или Hg
(c) Fe или Zn
(d) Ag или Pt
- Рассмотрим следующие металлы: Ag, Au, Mg, Ni и Zn.{\ circ} = -0,477 \; \ text {V}) [/ latex], и все же, когда оба подвергаются воздействию окружающей среды, необработанный алюминий имеет очень хорошую коррозионную стойкость, в то время как коррозионная стойкость необработанного железа оставляет желать лучшего. Объясните это наблюдение.
- Если образец железа и образец цинка соприкасаются, цинк разъедает, а железо — нет. Если образец железа соприкасается с образцом меди, железо разъедает, а медь — нет. Объясните этот феномен.
- Предположим, у вас есть три разных металла: A, B и C.{\ circ} = -3.04 \; \ text {V} [/ latex], который, кажется, может защитить все другие металлы, перечисленные в стандартной таблице восстановительного потенциала?
Глоссарий
- катодная защита
- Метод защиты металла с помощью расходуемого анода и эффективного получения металла, который требует защиты катода, предотвращая его окисление
- коррозия
- Разложение металла в результате электрохимического процесса
- оцинкованное железо
- способ защиты железа путем покрытия его цинком, который окисляется раньше железа; оцинкованное железо
- расходуемый анод
- более активный и недорогой металл, используемый в качестве анода в катодной защите; часто из магния или цинка
Решения
Ответы на упражнения в конце главы по химии
2.
