Воспользуйтесь поиском по сайту: |
Коррозия металлов и способы защиты от неё. (11 класс)
Похожие презентации:
Сложные эфиры. Жиры
Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Коррозия металлов и способы защиты от неё Урок химии в 11 классе
Автор: Дьяченко Людмила Александровна,учитель химии МБОУ «Парбигская СОШ»
Бакчарского района Томской области
2. КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функционал
КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое илихимическое взаимодействие между металлом
(сплавом) и средой, приводящее к ухудшению
функциональных свойств металла (сплава), среды
или включающей их технической системы.

Химический энциклопедический словарь
3. Слово коррозия происходит от латинского «corrodo» – «грызу» (позднелатинское «corrosio» означает «разъедание»).
Коррозия вызывается химической реакциейметалла с веществами окружающей среды,
протекающей на границе металла и среды. Чаще
всего это окисление металла, например,
кислородом воздуха или кислотами,
содержащимися в растворах, с которыми
контактирует металл. Особенно подвержены
этому металлы, расположенные в ряду
напряжений (ряду активности) левее водорода, в
том числе железо.
4. Химическая коррозия
0+4
0
t
2 Fe+ 3 SO2 + 3 O2
0
0
2 Fe + 3 Cl2
0
0
2 Zn + O2
t
Fe2(SO4)3
+3
2
t
+3 +6 -2
-1
FeCl3
+2 -2
2 ZnO
Коррозия происходит в непроводящей ток среде.
Например, взаимодействие металла с сухими газами или
жидкостями — неэлектролитами (бензином, керосином и т.д.)
5. Многие металлы (например, алюминий) при коррозии покрываются плотной, оксидной пленкой, которая не позволяет окислителям проникнуть в боле
Многие металлы (например, алюминий) при коррозиипокрываются плотной, оксидной пленкой, которая не
позволяет окислителям проникнуть в более глубокие
слои и потому предохраняет металл от коррозии.
 При
Приудалении этой пленки металл начинает
взаимодействовать с влагой и кислородом воздуха.
6. Электрохимическая коррозия
Коррозия происходит в токопроводящей среде (в электролите) свозникновением внутри системы электрического тока.
Металлы не однородны и содержат различные примеси. При
контакте их с электролитами одни участки поверхности
выполняют роль- анодов, другие- катодов.
Рассмотрим разрушение железного образца в присутствии
примеси олова.
1. В кислой среде:
На железе, как более активном металле, при соприкосновении с
электролитом происходят процессы окисления (растворения)
металла и перехода его катионов в электролит:
Fe0 – 2 e = Fe 2+ (анод)
На катоде (олово) происходит восстановление катионов
водорода:
2H+ + 2e h30
Ржавчина не образуется, т.к. ионы железа (Fe 2+) переходят в
раствор
8. 2. В щелочной или нейтральной среде:
Fe 0 – 2e Fe 2+ (на аноде)O20 + 2h3O + 4e 4OH – (на катоде)
________________________________________________________
Fe 2+ + 2 OH — Fe(OH)2
4 Fe (OH)2 + O2 + 2h3O = 4 Fe (OH)3
( Ржавчина)
9.
 В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать суммарным уравнением:4Fe + 6h3O (влага) + 3O2 (воздух) = 4Fe(OH)3
В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать суммарным уравнением:4Fe + 6h3O (влага) + 3O2 (воздух) = 4Fe(OH)310. Гидроксид железа(III) очень неустойчив, быстро теряет воду и превращается в оксид железа(III). Это соединение не защищает поверхность железа о
Гидроксид железа(III) очень неустойчив, быстро теряетводу и превращается в оксид железа(III). Это соединение
не защищает поверхность железа от дальнейшего
окисления. В результате железный предмет может
быть полностью разрушен.
Катионы
водорода и растворенный
кислород- важнейшие окислители,
вызывающие электрохимическую
коррозию
Скорость коррозии тем больше, чем
сильнее отличаются металлы по своей
активности
Значительно
усиливает коррозию
повышение температуры
14. Зимой для удаления снега и льда с тротуаров используют техническую соль. Образующиеся растворы создают благоприятную среду для электрохи
Зимой для удаления снега и льда с тротуаров используюттехническую соль.
 Образующиеся растворы создают
Образующиеся растворы создаютблагоприятную среду для электрохимической коррозии
подземных коммуникаций и деталей автомобилей.
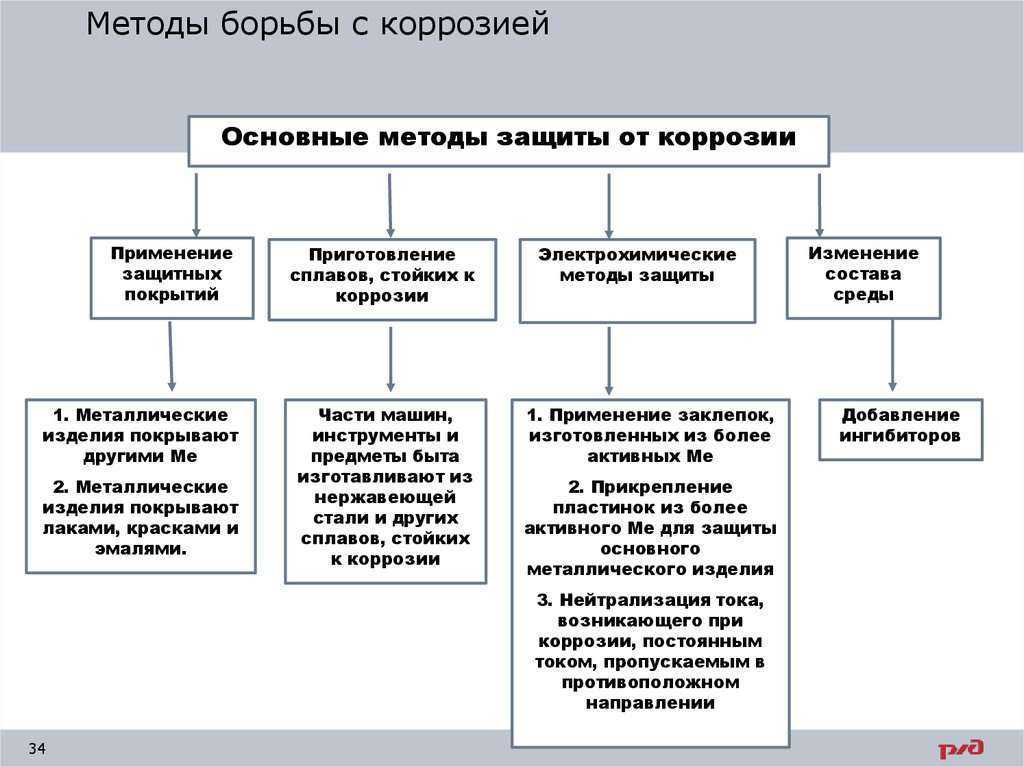
16. Способы защиты от коррозии
18. 1. Шлифование поверхностей изделия, чтобы на них не задерживалась влага. 2. Применение легированных сплавов, содержащих специальные добавки
: хром, никель, которые при высокой температуре наповерхности металла образуют устойчивый оксидный
слой(например Cr2O3).Общеизвестные легированные стали –
«нержавейки», из которых изготовляют предметы домашнего
обихода(ножи, вилки, ложки), детали машин, инструменты.
19. 3.Нанесение защитных покрытий
Неметаллические –неокисляющиеся масла,
специальные лаки, краски,
эмали. Правда,
они
3.Нанесение
защитных
покрытий
недолговечны, но зато дешевы.
Химические – искусственно
создаваемые поверхностные
плёнки: оксидные, нитридные,
силицидные, полимерные и др.
Например, все стрелковое
оружие и детали многих
точных приборов подвергают
воронению – это процесс
получения тончайшей плёнки
оксидов железа на поверхности
стального изделия.
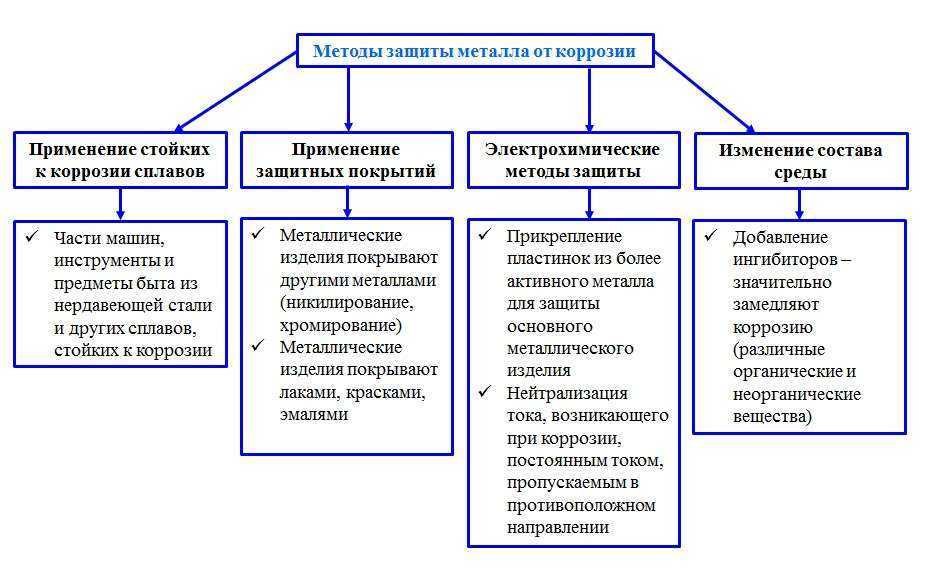
20. Металлические – это покрытие другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные плёнки.
Металлические – это покрытие другими металлами, на поверхности которыхпод действием окислителей образуются устойчивые защитные плёнки.
Нанесение хрома- хромирование, никеля — никелирование, цинка — цинкование и т.д.
Покрытием может служить и пассивный в химическом отношении металл –
золото, серебро, медь.
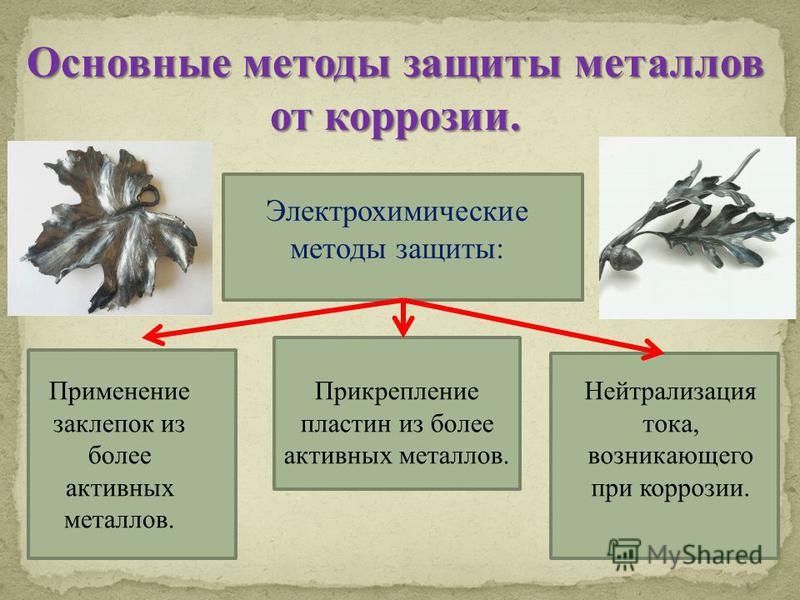
21. 4. Электрохимические методы защиты *Протекторная (анодная) – к защищаемой металлической конструкции присоединяют кусочек более активного
4. Электрохимические методы защиты*Протекторная (анодная) – к защищаемой металлической конструкции
присоединяют кусочек более активного металла (протектора), который
служит анодом и разрушается в присутствии электролита. В качестве
протектора при защите корпусов судов, трубопроводов, кабелей и др.
стальных изделий используются магний, алюминий,
*Катоднаяцинк.

– металлоконструкцию
подсоединяют к катоду внешнего
источника тока , что исключает
возможность её анодного
разрушения.
22. 5. Специальная обработка электролита или другой среды, в которой находится защитная металлическая конструкция
Введение веществ — ингибиторов, замедляющих коррозию. Примерыиспользования современных ингибиторов: соляная кислота при
перевозке и хранении прекрасно «укрощается» производными
бутиламина, а серная кислота –азотной кислотой; летучий
диэтиламин впрыскивают в различные ёмкости. Ингибиторы
действуют только на металл, делая его пассивным по отношению к
среде. Науке известно более 5 тыс. ингибиторов коррозии.
Удаление растворённого в воде кислорода (деаэрация). Этот
процесс используют при подготовке воды, поступающей в
котельные установки.
23. Спасибо за внимание!
24. Источники информации
Химия 11 класс: Учеб. для общеобразоват. учреждений /О.С.Габриелян, Г.Г.Лысова. – 4-е изд.
 , стереотип. — М.: Дрофа, 2004.
, стереотип. — М.: Дрофа, 2004.Картинки для презентации:
http://www.korobov.ru/articles/6227/
http://www.stroim-s-umom.ru/zh/rzhavchina-nash-obshhij-vrag/
http://auto60.ru/ArticleDetail.aspx?id=47
http://www.everest-expo.ru/page31.html
http://volpcar.ru/stati/zashchita-kuzova-ot-korrozii.html
http://dic.academic.ru/dic.nsf/ruwiki/19752
http://900igr.net/fotografii/khimija/Korrozija-metallov/019-Korrozijametallov.html
http://lozhki-vilki.ru/posuda-iz-nerzhavejushhej-stali/kak-vybrat-posuduiz-nerzhavejushhej-stali
25. Источники информации
http://smolchess.ru/otdelka-i-materialy/osnovnye-sposoby-borby-skorroziej-metallov.htmlhttp://vasi.net/community/all/2012/08/28/kak_zashhitit_instrument_ot_rzh
http://lori.ru/344835
http://lori.ru/64545
http://nnm.ru/blogs/Fortunato1991/o_tom_kak_rzhavye_gvozdi_prevratili
s_v_biznes_so_100-milliardnym_oborotom/
http://chemistry.ru/course/content/chapter7/section/paragraph5/theory.
 html
htmlhttp://transtim.narod.ru/zaschita_kuzova_avtomobilya_ot_korrozii_/ustroi
stvo_elektrohimicheskoi_zaschiti_ot_korrozii_kuzova_avtomobilya_/foto
grafii_ustanovlenoi_zaschiti_na_avtomobile/
English Русский Правила
Методы защиты коррозии | Статья в журнале «Молодой ученый»
Библиографическое описание:Тапаева, А. П. Методы защиты коррозии / А. П. Тапаева, Г. Т. Кожагельдиева. — Текст : непосредственный // Молодой ученый. — 2014. — № 1.2 (60.2). — С. 5-7. — URL: https://moluch.ru/archive/60/8920/ (дата обращения: 15.10.2022).
Коррозия – это самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды.
Коррозия металлов – разрушение металлов вследствие физико-химического воздействия внешней среды, при котором металл переходит в окисленное (ионное) состояние и теряет присущие ему свойства.
В тех случаях, когда окисление металла необходимо для осуществления какого-либо технологического процесса, термин “коррозия” употреблять не следует.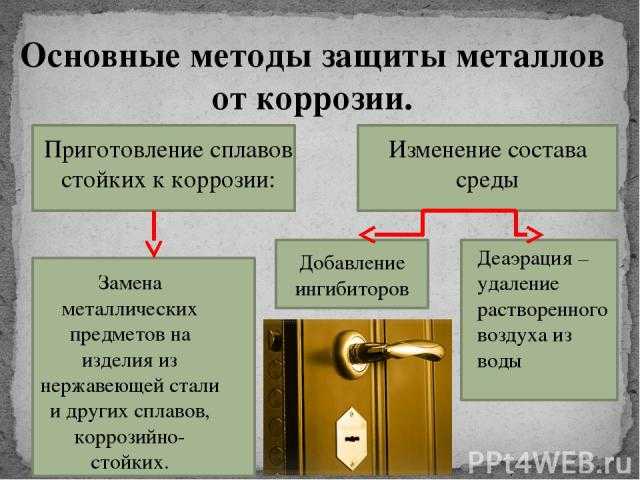 Например, нельзя говорить о коррозии растворимого анода в гальванической ванне, поскольку анод должен окислятся, посылая свои ионы в раствор, чтобы протекал нужный процесс. Нельзя также говорить о коррозии алюминия при осуществлении алюмотермического процесса. Но физико-химическая сущность изменений, происходящих с металлом во всех подобных случаях, одинакова: металл окисляется [1].
Например, нельзя говорить о коррозии растворимого анода в гальванической ванне, поскольку анод должен окислятся, посылая свои ионы в раствор, чтобы протекал нужный процесс. Нельзя также говорить о коррозии алюминия при осуществлении алюмотермического процесса. Но физико-химическая сущность изменений, происходящих с металлом во всех подобных случаях, одинакова: металл окисляется [1].
Проблема защиты металлов от коррозии возникла почти в самом начале их использования. Люди пытались защитить металлы от атмосферного воздействия с помощью жира, масел, а позднее и покрытием другими металлами и, прежде всего, легкоплавким оловом. В трудах древнегреческого историка Геродота (V век до нашей эры) уже имеется упоминание о применении олова для защиты железа от коррозии.
Задачей химиков было и остается выяснение сущности явлений коррозии, разработка мер, препятствующих или замедляющих её протекание. Коррозия металлов осуществляется в соответствии с законами природы и поэтому ее нельзя полностью устранить, а можно лишь замедлить [2].
По типу разрушений различают коррозию наружную (атмосферная и почвенная) и внутреннюю. Основным видом коррозии наружной поверхности промысловых трубопроводов является язвенная коррозия, а внутренней – равномерная или общая, происходящая в результате окислительно-восстановительныхгетерогенных процессов, происходящие на поверхности раздела фаз.
Коррозию классифицируют: по механизму, по площади повреждения, скорости распространения и виду коррозионного повреждения (3-схема).
3-схема.
В зависимости от характера коррозии и условий ее протекания применяются различные методы защиты. Выбор того или иного способа определяется его эффективностью в данном конкретном случае, а также экономической целесообразностью [3].
В производстве широко используется химическое нанесение металлических покрытий на изделия. Процесс химического металлирования является каталитическим или автокаталитическим, а катализатором является поверхность изделия. Используемый раствор содержит соединение наносимого металла и восстановитель. Поскольку катализатором является поверхность изделия, выделение металла и происходит именно на ней, а не в объеме раствора. В настоящее время разработаны методы химического покрытия металлических изделий никелем, кобальтом, железом, палладием, платиной, медью, золотом, серебром, родием, рутением и некоторыми сплавами на основе этих металлов. В качестве восстановителей используют гипофосфит и боргидрид натрия, формальдегид, гидразин. Естественно, что химическим никелированием можно наносить защитное покрытие не на любой металл.
Используемый раствор содержит соединение наносимого металла и восстановитель. Поскольку катализатором является поверхность изделия, выделение металла и происходит именно на ней, а не в объеме раствора. В настоящее время разработаны методы химического покрытия металлических изделий никелем, кобальтом, железом, палладием, платиной, медью, золотом, серебром, родием, рутением и некоторыми сплавами на основе этих металлов. В качестве восстановителей используют гипофосфит и боргидрид натрия, формальдегид, гидразин. Естественно, что химическим никелированием можно наносить защитное покрытие не на любой металл.
Металлические покрытия делят на две группы:
1. коррозионностойкие;
2. протекторные.
Например, для покрытия сплавов на основе железа в первую группу входят никель, серебро, медь, свинец, хром. Они более электроположительны по отношению к железу, то есть в электрохимическом ряду напряжений металлов стоят правее железа. Во вторую группу входят цинк, кадмий, алюминий. Они более электроотрицательны по отношению к железу.
Они более электроотрицательны по отношению к железу.
В повседневной жизни человек чаще всего встречается с покрытиями железа цинком и оловом. Листовое железо, покрытое цинком, называют оцинкованным железом, а покрытое оловом – белой жестью. Первое в больших количествах идет на кровли домов, а второе – на изготовление консервных банок. Впервые способ хранения пищевых продуктов в жестяных банках предложил повар Н.Ф. Аппер в 1810 году. И то, и другое железо получают, главным образом, протягиванием листа железа через расплав соответствующего металла.
Металлические покрытия защищают железо от коррозии при сохранении сплошности. При нарушении же покрывающего слоя коррозия изделия протекает даже более интенсивно, чем без покрытия. Это объясняется работой гальванического элемента железо–металл. Трещины и царапины заполняются влагой, в результате чего образуются растворы, ионные процессы в которых облегчают протекание электрохимического процесса (коррозии) [4].
Применение ингибиторов – один из самых эффективных способов борьбы с коррозией металлов в различных агрессивных средах. Ингибиторы – это вещества, способные в малых количествах замедлять протекание химических процессов или останавливать их. Название ингибитор происходит от латинского inhibere, что означает сдерживать, останавливать. Ещё по данным 1980 года, число известных науке ингибиторов составило более пяти тысяч. Ингибиторы дают народному хозяйству немалую экономию.
Ингибиторы – это вещества, способные в малых количествах замедлять протекание химических процессов или останавливать их. Название ингибитор происходит от латинского inhibere, что означает сдерживать, останавливать. Ещё по данным 1980 года, число известных науке ингибиторов составило более пяти тысяч. Ингибиторы дают народному хозяйству немалую экономию.
Ингибирующее воздействие на металлы, прежде всего на сталь, оказывает целый ряд неорганических и органических веществ, которые часто добавляются в среду, вызывающую коррозию. Ингибиторы имеют свойство создавать на поверхности металла очень тонкую пленку, защищающую металл от коррозии.
Ингибиторы в соответствии с Х. Фишером можно сгруппировать следующим образом:
1) Экранирующие, то есть покрывающие поверхность металла тонкой пленкой. Пленка образуется в результате поверхностной адсорбции. При воздействии физических ингибиторов химических реакций не происходит;
2) Окислители (пассиваторы) типа хроматов, вызывающие образование на поверхности металла плотно прилегающего защитного слоя окисей, которые замедляют протекание анодного процесса. Эти слои не очень стойки и при определенных условиях могут подвергаться восстановлению. Эффективность пассиваторов зависит от толщины образующегося защитного слоя и его проводимости;
Эти слои не очень стойки и при определенных условиях могут подвергаться восстановлению. Эффективность пассиваторов зависит от толщины образующегося защитного слоя и его проводимости;
3) Катодные – повышающие перенапряжение катодного процесса. Они замедляют коррозию в растворах неокисляющих кислот. К таким ингибиторам относятся соли или окислы мышьяка и висмута.
Эффективность действия ингибиторов зависит в основном от условий среды, поэтому универсальных ингибиторов нет. Для их выбора требуется проведение исследований и испытаний.
Наиболее часто применяются следующие ингибиторы: нитрит натрия, добавляемый, например, к холодильным соляным растворам, фосфаты и силикаты натрия, бихромат натрия, различные органические амины, сульфоокись бензила, крахмал, танин и т. п. Поскольку ингибиторы со временем расходуются, они должны добавляться в агрессивную среду периодически. Количество ингибитора, добавляемого в агрессивные среды, невелико. Например, нитрита натрия добавляют в воду в количестве 0,01-0,05%.
Ингибиторы подбираются в зависимости от кислого или щелочного характера среды. Например, часто применяемый в качестве ингибитора нитрит натрия может использоваться в основном в щелочной среде и перестает быть эффективным даже в слабокислых средах [5, 6].
Металлы составляют одну из основ цивилизации на планете Земля. Их широкое внедрение в промышленное строительство и транспорт произошло на рубеже XVIII-XIX. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Начало практического использования человеком железа относят к IX веку до нашей эры. Именно в этот период человечество перешло из бронзового века в век железный.
В XXI веке высокие темпы развития промышленности, интенсификация производственных процессов, повышение основных технологических параметров (температура, давление, концентрация реагирующих средств и др.) предъявляют высокие требования к надежной эксплуатации технологического оборудования и строительных конструкций. Особое место в комплексе мероприятий по обеспечению бесперебойной эксплуатации оборудования отводится надежной защите его от коррозии и применению в связи с этим высококачественных химически стойких материалов.
Особое место в комплексе мероприятий по обеспечению бесперебойной эксплуатации оборудования отводится надежной защите его от коррозии и применению в связи с этим высококачественных химически стойких материалов.
Необходимость осуществления мероприятий по защите от коррозии диктуется тем обстоятельством, что потери от коррозии приносят чрезвычайно большой ущерб. По имеющимся данным, около 10% ежегодной добычи металла расходуется на покрытие безвозвратных потерь вследствие коррозии и последующего распыления. Основной ущерб от коррозии металла связан не только с потерей больших количеств металла, но и с порчей или выходом из строя самих металлических конструкций, т.к. вследствие коррозии они теряют необходимую прочность, пластичность, герметичность, тепло- и электропроводность, отражательную способность и другие необходимые качества. К потерям, которые терпит народное хозяйство от коррозии, должны быть отнесены также громадные затраты на всякого рода защитные антикоррозионные мероприятия, ущерб от ухудшения качества выпускаемой продукции, выход из строя оборудования, аварий в производстве и так далее.
Защита от коррозии является одной из важнейших проблем, имеющей большое значение для народного хозяйства.
Коррозия является физико-химическим процессом, защита же от коррозии металлов – проблема химии в чистом виде [7].
Сегодня говорить о том, что коррозия металла как процесс его разрушения практически побежден, преждевременно. И проблем здесь хватает. Но ученые прилагают все усилия, чтобы коррозия металла как можно меньше доставляла неудобств в процессе эксплуатации металлических конструкций.
Все больше появляется методов борьбы с этим процессом, все больше появляется материалов, которые гарантируют эффективную защиту. На исследования тратятся большие финансовые средства, поэтому коррозия металла должна отступить в будущем, а точнее сказать, сдать свои позиции. Коррозия металлов и меры борьбы с ней – это одна из главных задач, которую ставят перед собой строители, начиная поднимать новый объект.
Литература:
1. Андреев И.Н. Коррозия металлов и их защита. – Казань: Татарское книжное издательство, 2001. – С. 68-70.
– Казань: Татарское книжное издательство, 2001. – С. 68-70.
2. Лукьянов П.М. Краткая история химической промышленности. – М.: Издательство АН СССР, 1999. – С. 55-56
3. Чухарева Н.В., Абрамова Р.Н., Болсуновская Л.М. – Коррозионные повреждения при транспорте скважинной продукции. – Томск, 2009. — С. 5-6.
4. Войтович В.А., Мокеева Л.Н. Биологическая коррозия. – М.: Знание, 2000. – С. 70.
5. Шехтер Ю.Н., Ребров И.Ю., Легезин Н.Е. и др. Некоторые проблемы ингибирования коррозии // Защита металлов, 1998, Т.34. — № 6. — С. 638-641.
6. Козлов А.А., Прохорова Н.П., Бограчев А.М. Новейшие тенденции в разработке и применении ингибиторов коррозии для водоохлаждающих систем // Химическая промышленность. – 1986. — № 1. — С. 40-41.
7. Улиг Г.Г., Реви Р.У. Коррозия и борьба с ней. – Л.: Химия, 2000. – С. 30-35.
Основные термины (генерируются автоматически): коррозия, коррозия металлов, ингибитор, коррозия металла, металл, народное хозяйство, нитрит натрия, поверхность металла, процесс, тонкая пленка.
Предотвращение коррозии металла |
Зачем беспокоиться о предотвращении коррозии металла? Коррозия металла – серьезная проблема. Ежегодные затраты на коррозию во всем мире составляют 2,2 трлн долларов США, что составляет более 3% мирового ВВП.
Когда возникает коррозия, она представляет реальную угрозу конструкциям. Могут быть затронуты здания, дороги и мосты, а это означает, что коррозия металла ставит под угрозу безопасность населения.
Предотвращение коррозии металлов является важной задачей, поскольку это не только экономит деньги, но и спасает жизни.
В этой статье объясняется, что такое коррозия, как она возникает, как лучше всего предотвратить коррозию металла и как защитить свою тяжелую работу.
Чтобы получить современную отделку, обеспечивающую непревзойденную коррозионную стойкость в самых суровых условиях, свяжитесь с нами по адресу https://minnesotaindustrialcoatings.com/
Что такое коррозия металлов?
Проще говоря, коррозия металла — это процесс, при котором металл взаимодействует с окружающей средой, такой как воздух и вода, и разрушается.
Скорость и степень этого износа зависят от нескольких факторов, включая тип металла и условия окружающей среды.
Для возникновения коррозии металла необходимы три условия. Это влага, открытая металлическая поверхность и окислитель.
При коррозии железа и стали образующийся оксид широко известен как ржавчина.
Есть несколько способов минимизировать коррозию.
Некоторые металлы более подвержены коррозии?
Некоторые металлы более подвержены коррозии, чем другие, например, чистое железо. Но все металлы подвержены тому или иному типу коррозии металла.
Ржавчина — это особый тип коррозии или окисления, который возникает только у черных металлов (содержащих железо).
Некоторыми часто используемыми черными металлами являются углеродистая сталь, легированная сталь и нержавеющая сталь. Другие металлы, не содержащие железа, могут подвергаться коррозии, но не ржаветь.
Предотвращение коррозии металла начинается с выбора подходящего металла. Некоторые металлы более устойчивы к коррозии. Например, нержавеющая сталь (сочетание стали с железом и другими сплавами) подвержена значительно более медленной коррозии.
Некоторые металлы более устойчивы к коррозии. Например, нержавеющая сталь (сочетание стали с железом и другими сплавами) подвержена значительно более медленной коррозии.
Хотя сплавы нержавеющей стали содержат железо, они устойчивы к ржавчине, поскольку содержат высокий процент хрома. Хром очень быстро окисляется и создает слой оксида хрома на поверхности металла. Таким образом, он предотвращает попадание кислорода в сталь под ним.
Небольшая группа благородных металлов, обладающих сверхстойкостью к коррозии, включает золото, серебро, платину, родий и палладий.
Почему или как возникает коррозия?
Коррозия вызывается средой, окружающей металл. Это результат химической реакции, которая происходит, когда металл реагирует с окружающими жидкостями и газами.
Как отмечалось ранее, для коррозии стали необходима влага. Следовательно, для коррозии стали необходим электролит, а многие электролиты представляют собой растворы в воде или каком-либо другом растворителе. Ржавчина возникает, когда железо подвергается воздействию дождя и влаги в воздухе, соленой воде, кислотах или других агрессивных химикатах. Металл и влага реагируют с кислородом и образуют ржавчину.
Ржавчина возникает, когда железо подвергается воздействию дождя и влаги в воздухе, соленой воде, кислотах или других агрессивных химикатах. Металл и влага реагируют с кислородом и образуют ржавчину.
Вот почему сталь медленнее корродирует в сухом климате. Однако во влажном и дождливом климате защита стали имеет жизненно важное значение. Следующие среды усугубляют процесс коррозии:
Коррозия в промышленных зонах происходит быстрее из-за кислот, щелочей и других химических веществ, содержащихся в дыме и других испарениях.
Соленая вода разъедает сталь быстрее, чем пресная. Именно поэтому районы вблизи океана особенно опасны из-за воздействия соленого воздуха.
Подземные трубы также особенно подвержены коррозии, поскольку глина и почва являются хорошими проводниками электричества.
Есть ли способ предотвратить коррозию металла?
Коррозия металла — это реальность, с которой приходится сталкиваться каждому, кто использует металл. Знание причин коррозии является первым шагом к пониманию того, что вы можете сделать, чтобы предотвратить ее.
Мы знаем, что для коррозии необходимы три вещи: электролит, открытый металл и акцептор электронов (воздух).
Коррозию металлов можно предотвратить, эффективно устранив одно из этих условий.
Например, покрытие металлической поверхности создает барьер между металлом и влагой окружающей среды.
Давайте теперь рассмотрим этот метод покрытия металлов для предотвращения коррозии и другие более подробно.
Как можно предотвратить коррозию металлов?
Вот несколько общих способов предотвращения коррозии:
- Техническое обслуживание
- Принять меры по изменению окружающей среды
- Использовать жертвенное покрытие
- Использовать защитное покрытие
Техническое обслуживание
90 интенсивный, но эффективный способ замедлить разрушительное воздействие коррозии. Во-первых, вы можете физически соскоблить ржавчину как можно быстрее после ее появления. Затем удалите его старым добрым методом очистки с мылом и водой.
Меры по охране окружающей среды
Окружающая среда является основной причиной коррозии. Поэтому логически, если вы можете контролировать эту среду, вы можете снизить риск коррозии.
В качестве простого примера рассмотрим очистку воды в водогрейных котлах. Обработка изменяет такие факторы, как жесткость, щелочность или содержание кислорода. В результате металл, который вступает в контакт с этой водой, будет иметь меньшую скорость коррозии.
Жертвенные покрытия
Временное покрытие относится к одному из методов покрытия металлов для предотвращения коррозии. Покрытие металлической поверхности другим металлом, который с большей вероятностью окисляется, защищает базовый слой.
Например, сталь часто покрывают цинком, который легче окисляется. Цинк «приносится в жертву» для защиты железа в стали. Этот тип защиты называется «катодной защитой», также известной как цинкование.
Другим способом защиты металла является «анодная защита». Это включает нанесение покрытия из менее легко окисляемого металла, такого как олово.
Используйте защитное покрытие
Одним из наиболее эффективных способов предотвращения коррозии и ржавчины является защита металлоконструкций промышленными покрытиями. Покрытие металлов краской или эмалью для предотвращения гниения является высокоэффективным методом. Он создает барьер между металлом и влагой и кислородом окружающей среды.
Чем выше качество покрытия, тем выше защита. Minnesota Industrial Coatings (MIC) поставляет неизменно высококачественные промышленные покрытия, в том числе порошковые и гальванопокрытия.
Мы являемся одной из немногих компаний, которые могут предложить как порошковое покрытие, так и электронное покрытие. Таким образом, при совместном использовании (основа E-coat с верхним покрытием Powder) вы получаете лучшее из обоих миров.
В результате получается качественная отделка, множество вариантов цвета и непревзойденная коррозионная стойкость даже в самых суровых условиях.
Да, коррозия металла — серьезная проблема. Защитите свою работу с помощью наилучшей коррозионной стойкости, химической стойкости, устойчивости к царапинам, стойкости к сколам и износоустойчивой поверхности.
Защитите свою работу с помощью наилучшей коррозионной стойкости, химической стойкости, устойчивости к царапинам, стойкости к сколам и износоустойчивой поверхности.
Чтобы запросить оценку, свяжитесь с нами сегодня!
Средства индивидуальной защиты, необходимые для порошкового покрытия и анодирования
Minnesota Industrial Coatings 8 октября 2022 г.
Что лучше всего работает при покрытии металлических поверхностей и какие процессы связаны между порошковым покрытием и анодированием? Знаете ли вы основные правила техники безопасности для…
Подробнее »
Сколько стоит порошковое покрытие?
Minnesota Industrial Coatings 20 сентября 2022 г.
Вы можете задаться вопросом, дорого ли стоит порошковая краска, но вы находитесь на нужном веб-сайте, чтобы узнать об этом! В Minnesota Industrial Coatings мы гордимся…
Подробнее »
Как предотвратить коррозию — Cor Pro
Коррозия – это разрушение металлов в результате химической реакции с окружающей средой. Коррозия возникает из-за окисления металлов из-за воздействия катализаторов, таких как воздух и вода. Когда металлы реагируют на коррозионные катализаторы, возникает коррозия, и они медленно разрушают металлы до полной деградации.
Коррозия возникает из-за окисления металлов из-за воздействия катализаторов, таких как воздух и вода. Когда металлы реагируют на коррозионные катализаторы, возникает коррозия, и они медленно разрушают металлы до полной деградации.
Существуют различные формы коррозионного воздействия на металлы. Каждый тип коррозии зависит от уровня воздействия катализатора на металл, а также от типа металла, подверженного коррозии.
Ржавчина является наиболее распространенной формой коррозии с одинаковым уровнем деградации на всех участках оборудования. Другие типы коррозии включают гальваническую коррозию, щелевую коррозию, точечную коррозию, межкристаллитную коррозию, селективное выщелачивание, эрозию и коррозию под напряжением.
Коррозия — естественный процесс, но надлежащее управление коррозией может замедлить его с помощью экспертов в отрасли. Надлежащие методы защиты от коррозии требуют современного оборудования, обширных знаний в области управления и предотвращения коррозии, а также обученного персонала, готового работать с любой формой коррозионного воздействия.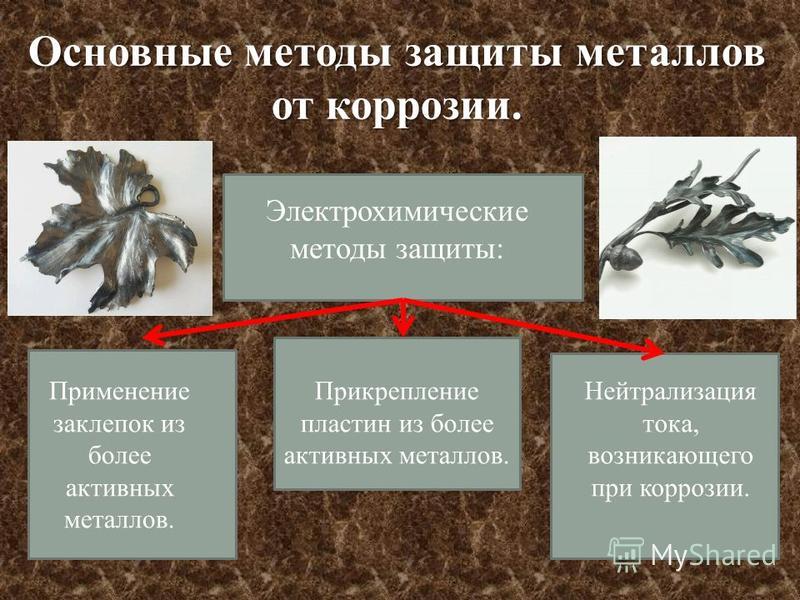
Почти 30 лет компания Cor-Pro Systems возглавляет антикоррозионную отрасль на побережье Мексиканского залива и предлагает своим клиентам только лучшие услуги по защите от коррозии.
Типы методов предотвращения коррозии
Существуют различные способы предотвращения коррозии металлов. Эти методы различаются в зависимости от различных переменных, таких как тип металла, окружающая среда, тип коррозионного агента и других, чтобы обеспечить эффективную защиту от коррозии, которая может действовать в течение длительного времени.
Среди наиболее распространенных методов защиты от коррозии:
- Ингибиторы коррозии. Ингибиторы коррозии — это химические вещества, добавляемые в оборудование для образования тонкого слоя защиты от катализаторов коррозии. Эти присадки добавляются даже во время работы защищаемой машины. Хотя ингибиторы смешиваются с жидкостью во время нанесения, последняя не влияет на качество добавок. Хранилища жидкостей являются одними из частых клиентов, которые получают ингибиторы коррозии.

- Покрытия. Покрытие — самый простой способ защитить ваше оборудование. Покрывающие материалы, такие как эпоксидная смола, уретан и цинк, могут добавить дополнительный уровень защиты вашим объектам при правильном нанесении и отверждении. Покрытия зависят от защищаемого материала и типа используемого химического соединения.
- Абразивоструйная очистка. При абразивоструйной очистке используется высокоскоростная машина, которая перемещает среду к поверхности материала. При этом вы можете контролировать ущерб, вызванный коррозией, и подготовить его к нанесению антикоррозионных материалов. Обычно абразивоструйную очистку проводят непосредственно перед нанесением на поверхность оборудования других антикоррозионных материалов.
Преимущества защиты стали от коррозии
Cor-Pro Systems обеспечивает качественную защиту стали от коррозии в Хьюстоне, штат Техас, и других районах побережья Мексиканского залива. Ниже приведены преимущества получения высококачественной защиты стали от коррозии с помощью Cor-Pro Systems:
- Качественная защита от коррозии может продлить срок службы вашего оборудования на 250% .

- Защита от коррозии может снизить затраты на ремонт из-за коррозионного повреждения.
- Защищенное оборудование может избежать перерывов в обслуживании и сбоев в работе .
- Защита от коррозии может спасти жизни от травм, вызванных атмосферными воздействиями оборудования и объектов.
- Предотвращая травмы и ущерб от коррозии оборудования, компании могут избежать юридических и экологических обязательств .
Благодаря многолетнему опыту работы с самыми сложными методами борьбы с коррозией у широкого круга клиентов, Cor-Pro Systems предоставит специализированные услуги по управлению коррозией стали, которые специально разработаны в зависимости от потребностей клиента.
Скорость: часть приверженности Cor-Pro «золотому стандарту Cor-Pro»
Беспрецедентное отсутствие отказов в защите от коррозии Cor-Pro Systems и послужной список поставок на трассе, мы можем заверить вас, что вы не получите ничего, кроме « Cor-Pro Gold Standard», высшая сертификация в области защиты от коррозии.
С помощью нашего сервиса Velocity вы получите готовые проекты по защите от коррозии в течение нескольких часов, а не дней. Кроме того, наш высококвалифицированный персонал позаботится о том, чтобы вы были в курсе наших проектов по мере их реализации.
О Cor-Pro Systems
С 1987 года Cor-Pro Systems Inc. обеспечивает первоклассную защиту от коррозии в Хьюстоне и других районах на побережье Мексиканского залива. Наша цель — повысить осведомленность о коррозии и ее влиянии на всю отрасль, а также обеспечить удовлетворительную защиту от коррозии с помощью наших качественных методов, основанных на многолетних обширных исследованиях и разработках.
Помимо нашей беспрецедентной репутации в обеспечении защиты от коррозии для наших клиентов, мы также обязательно поддерживаем долгосрочные отношения с нашими партнерами, чтобы гарантировать, что они никогда не столкнутся с инцидентами, связанными с коррозией в будущем.
Высококачественные методы борьбы с коррозией с помощью Cor-Pro Systems, Inc.
 электронная почта на [email protected] .
электронная почта на [email protected] . Способы предотвращения коррозии металлов – Услуги по нанесению золотых покрытий
Под коррозией понимается постепенный износ и разрушение металла. Хотя это естественное явление, возникающее из-за реакции с окружающей средой, оно может серьезно подорвать эстетику и функциональность металлических изделий.
(Pixabay / Renee_Olmsted_Photography)
Наиболее распространенным типом коррозии является ржавчина, которая возникает в результате контакта влажного воздуха с железом с образованием гидратированного оксида железа. Чистое золото не подвергается коррозии, но серебро, бронза и другие подобные металлы могут «тускнеть» — это означает, что на основном металле образуется тонкий слой коррозии. Оцинкованные изделия (изделия из железа или стали, покрытые защитным слоем цинка) также подвержены коррозии, но более медленными темпами, если оцинкованное покрытие еще не повреждено.
Теперь, когда у вас есть общее представление о коррозии, как ее предотвратить? Ниже мы рассмотрим некоторые из наиболее распространенных методов профилактики.
1. Охрана окружающей среды
Некоторые факторы окружающей среды повышают вероятность коррозии металла. Хранение металла в чистом и сухом месте, когда он не нужен, позволяет свести к минимуму появление ржавчины. Кроме того, принятие мер по снижению содержания кислорода, серы и хлора в окружающей среде может замедлить темпы износа металла. Например, когда речь идет о водонагревателе, вы можете использовать умягчители для обработки питательной воды, чтобы изменить содержание кислорода или щелочность. Это уменьшит риск коррозии внутренней части устройства.
2. Нанесите защитное покрытие
Это может обеспечить уровень защиты от ржавчины, выступая в качестве барьера между окисляющими компонентами в окружающей среде и металлическими частями. Часто используемым методом защитного покрытия является гальванизация, когда производители используют тонкий слой цинка для покрытия детали. Еще одним жизнеспособным вариантом предотвращения коррозии металлов является порошковое покрытие. При правильном подходе порошковое покрытие может скрыть поверхность детали от внешних элементов для защиты от коррозии.
При правильном подходе порошковое покрытие может скрыть поверхность детали от внешних элементов для защиты от коррозии.
3. Использование катодной защиты
Катодная защита преобразует ненужные анодные участки на поверхности металла в катодные за счет использования противоположного тока. Наиболее часто используемый метод катодной защиты предполагает использование гальванических анодов. В процессе используются металлические аноды, которые жертвуют собой, чтобы защитить катод от внешних факторов. Эти расходуемые аноды обычно изготавливаются из магния, цинка или алюминия. Однако производители нередко переключаются между гальваническими анодами и катодной защитой. В последнем случае отрицательная клемма тока подключена к металлу, а положительная клемма подключена к вспомогательному аноду для замыкания цепи.
4. Борьба с ржавчиной на этапе проектирования
Если металл будет использоваться в среде, где он подвержен коррозии, производители должны создавать деталь с учетом этих знаний. Например, металлические детали, которые подвергаются воздействию элементов окружающей среды, должны позволять мусору и воде стекать, а не собираться на поверхности. Точно так же следует устранить узкие зазоры, через которые может поступать жидкость или воздух, чтобы предотвратить щелевую коррозию. Для агрессивных по своей природе сред, таких как соленая вода, может быть хорошей идеей произвести определенную степень ржавчины.
Например, металлические детали, которые подвергаются воздействию элементов окружающей среды, должны позволять мусору и воде стекать, а не собираться на поверхности. Точно так же следует устранить узкие зазоры, через которые может поступать жидкость или воздух, чтобы предотвратить щелевую коррозию. Для агрессивных по своей природе сред, таких как соленая вода, может быть хорошей идеей произвести определенную степень ржавчины.
5. Приобретите ингибиторы
Ингибиторы относятся к химическим веществам, которые вступают в реакцию с газами окружающей среды или поверхностью металла, нарушая химические процессы, ведущие к коррозии. Они работают, впитываясь в поверхность металла, создавая защитную пленку. Пользователи могут наносить их в качестве защитного покрытия или в виде раствора с помощью методов диспергирования. Скорость, с которой ингибитор замедляет коррозию, зависит от повышения электрического сопротивления на поверхности или уменьшения диффузии ионов к поверхности.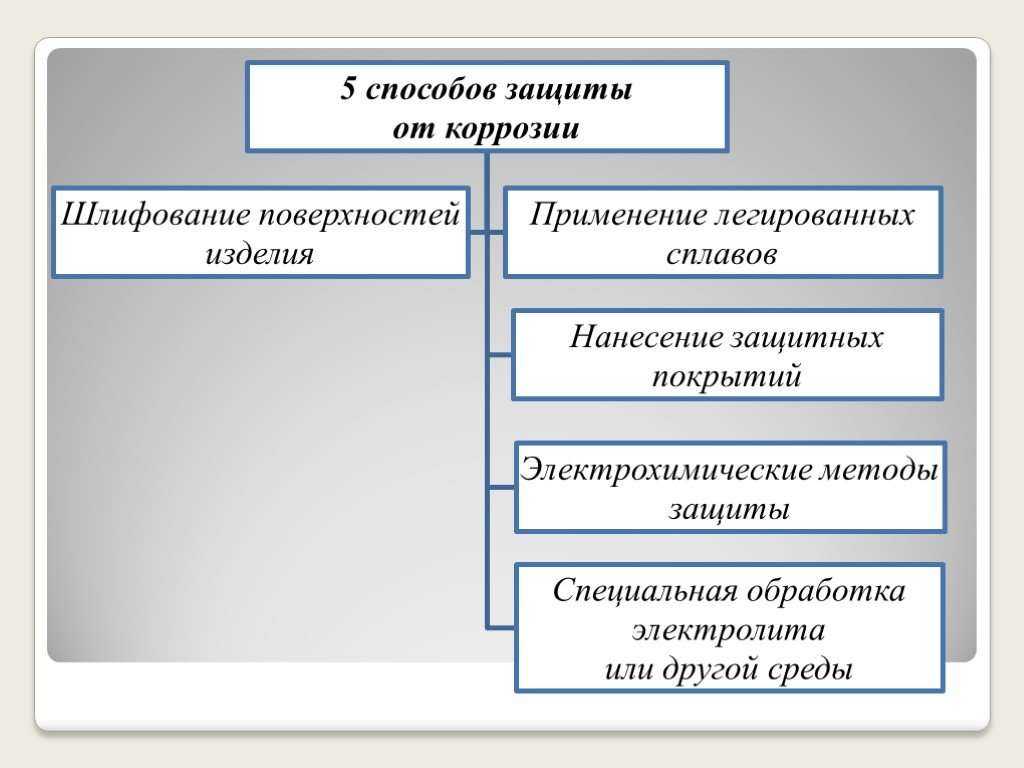 Еще одним преимуществом ингибиторов является то, что их можно использовать в качестве корректирующего действия для смягчения внезапной коррозии.
Еще одним преимуществом ингибиторов является то, что их можно использовать в качестве корректирующего действия для смягчения внезапной коррозии.
6. Легированная сталь
Легированная сталь — один из лучших способов защиты от коррозии. Он сочетает в себе компоненты из нескольких металлов, чтобы придать изделию дополнительную прочность и прочность. Никель, устойчивый к коррозии, можно смешать с хромом, ограничивающим окисление, для создания сплава, который можно использовать в восстановленных и окисленных средах. Различные сплавы обеспечивают устойчивость к различным средам, предоставляя заинтересованным сторонам повышенную гибкость. Однако легированная сталь непрактична с точки зрения стоимости. Производителям с ограниченным бюджетом придется использовать другую тактику.
7. Следите за состоянием поверхности
Мониторинг состояния поверхности металла также имеет решающее значение для ее защиты от возможной коррозии. Шероховатые поверхности, щели или трещины, являющиеся побочным продуктом конструктивных недостатков или износа, могут привести к более высокой скорости коррозии. Адекватный мониторинг и устранение нежелательных поверхностных состояний является эффективной частью предотвращения коррозии. Кроме того, производители могут принять меры, чтобы гарантировать, что коррозионные элементы не используются при обслуживании или очистке металлических деталей, а также чтобы избежать реактивных комбинаций металлов.
Адекватный мониторинг и устранение нежелательных поверхностных состояний является эффективной частью предотвращения коррозии. Кроме того, производители могут принять меры, чтобы гарантировать, что коррозионные элементы не используются при обслуживании или очистке металлических деталей, а также чтобы избежать реактивных комбинаций металлов.
8. Гальваническое покрытие
Это процесс, в котором положительно заряженный металл покрывает отрицательно заряженный основной металл. Однако гальваническое покрытие требует источника питания и не может происходить естественным путем. Это позволяет производителям создавать изделия из недорогих основных металлов, а затем использовать высококачественные металлы для обеспечения необходимого покрытия. Если они хотят разрабатывать продукты, в которых используются только высококачественные металлы, им потребуется гораздо больше капитала. Гальваника, с другой стороны, выгодна для кошелька. Помимо сведения к минимуму коррозии, гальваническое покрытие можно использовать для устранения трения, улучшения эстетики, уменьшения подверженности предметов износу и повышения проводимости.


 Переход атомов металла в ионы и растворение их в жидком электролите определяется величиной нормального электродного потенциала. Он характеризует то напряжение электрического тока, которое надо приложить к границе раздела твердого металла с жидким электролитом, чтобы воспрепятствовать переходу иона металла в раствор. Чем отрицательнее нормальный электродный потенциал, тем более резко выражено стремление металла к растворению в электролитах (например, свинец растворяется значительно медленнее, чем железо). Данный вид коррозии может также возникнуть при контакте двух разнородных металлов в присутствии электролита, когда между этими металлами возникает гальванический ток. В гальванической паре любых двух металлов будет растворяться тот металл, который обладает более отрицательным электродным потенциалом. Например, железо имеет более низкий отрицательный электродный потенциал, чем цинк, и более высокий, чем медь. Следовательно, при контакте железа с цинком будет разрушаться цинк, а при контакте железа с медью — железо.
Переход атомов металла в ионы и растворение их в жидком электролите определяется величиной нормального электродного потенциала. Он характеризует то напряжение электрического тока, которое надо приложить к границе раздела твердого металла с жидким электролитом, чтобы воспрепятствовать переходу иона металла в раствор. Чем отрицательнее нормальный электродный потенциал, тем более резко выражено стремление металла к растворению в электролитах (например, свинец растворяется значительно медленнее, чем железо). Данный вид коррозии может также возникнуть при контакте двух разнородных металлов в присутствии электролита, когда между этими металлами возникает гальванический ток. В гальванической паре любых двух металлов будет растворяться тот металл, который обладает более отрицательным электродным потенциалом. Например, железо имеет более низкий отрицательный электродный потенциал, чем цинк, и более высокий, чем медь. Следовательно, при контакте железа с цинком будет разрушаться цинк, а при контакте железа с медью — железо.
 Разрушение металла одновременным воздействием знакопеременных нагрузок и коррозионной среды называют коррозионной усталостью.
В зависимости от характера окружающей среды электрохимическая коррозия может быть подводной, атмосферной, почвенной, вызванной блуждающими токами. Электрохимическая коррозия металлов в воде обусловливается присутствием в ней растворенного кислорода. При атмосферной коррозии электролитом служит тонкая пленка влаги, сам же процесс коррозии ничем не отличается от коррозии в воде.
В результате коррозии стали на ее поверхности появляется смесь различных гидратированных оксидов железа, имеющих состав «FeO-ph3O+mFe2O3-<?h3O (ржавчина).
Активному протеканию процесса коррозии способствует углекислый и в особенности сернистый газы, хлористый водород, различные соли.
Защиту от коррозии следует начинать с правильного подбора химического состава и структуры металла. При конструировании необходимо избегать форм, способствующих задержке влаги.
Разрушение металла одновременным воздействием знакопеременных нагрузок и коррозионной среды называют коррозионной усталостью.
В зависимости от характера окружающей среды электрохимическая коррозия может быть подводной, атмосферной, почвенной, вызванной блуждающими токами. Электрохимическая коррозия металлов в воде обусловливается присутствием в ней растворенного кислорода. При атмосферной коррозии электролитом служит тонкая пленка влаги, сам же процесс коррозии ничем не отличается от коррозии в воде.
В результате коррозии стали на ее поверхности появляется смесь различных гидратированных оксидов железа, имеющих состав «FeO-ph3O+mFe2O3-<?h3O (ржавчина).
Активному протеканию процесса коррозии способствует углекислый и в особенности сернистый газы, хлористый водород, различные соли.
Защиту от коррозии следует начинать с правильного подбора химического состава и структуры металла. При конструировании необходимо избегать форм, способствующих задержке влаги.

 е. наложения на основной металл тонкого слоя защитного металла (биметалл) и зарепления его путем горячей прокатки (например, железо — медный сплав, дюралюминий — чистый алюминий).
Оксидирование — защита оксидными пленками. Для этого естественную оксидную пленку, всегда имеющуюся на металле, делают более прочной путем обработки сильным окислителем, например концентрированной азотной кислотой, растворами марганцевой или хромовой кислот и их солей. Частным случаем оксидирования является воронение стали. В этом случае на поверхности также создается оксидная пленка, но более сложными приемами, связанными с многократной термической обработкой при температуре ЗО0…40О°С в присутствии древесного угля.
Фосфатирование состоит в получении на изделии поверхностной пленки из нерастворимых солей железа или марганца в результате погружения металла в горячие растворы кислых фосфатов железа или марганца.
Лакокрасочные покрытия основаны на механической защите металла пленкой из различных красок и лаков.
е. наложения на основной металл тонкого слоя защитного металла (биметалл) и зарепления его путем горячей прокатки (например, железо — медный сплав, дюралюминий — чистый алюминий).
Оксидирование — защита оксидными пленками. Для этого естественную оксидную пленку, всегда имеющуюся на металле, делают более прочной путем обработки сильным окислителем, например концентрированной азотной кислотой, растворами марганцевой или хромовой кислот и их солей. Частным случаем оксидирования является воронение стали. В этом случае на поверхности также создается оксидная пленка, но более сложными приемами, связанными с многократной термической обработкой при температуре ЗО0…40О°С в присутствии древесного угля.
Фосфатирование состоит в получении на изделии поверхностной пленки из нерастворимых солей железа или марганца в результате погружения металла в горячие растворы кислых фосфатов железа или марганца.
Лакокрасочные покрытия основаны на механической защите металла пленкой из различных красок и лаков.