Коррозия металлов и способы защиты от нее
Коррозия металлов и способы защиты от нееКоррозия металлов — процесс разрушения металлов и сплавов вследствие химического или электрохимического взаимодействия с внешней средой, при котором металлы окисляются и теряют присущие им свойства. Ежегодно в мире в результате коррозии теряется 10…15% выплавляемого металла или 1-1,5% всего металла, накопленного и эксплуатируемого человеком. В наибольшей степени коррозии подвергаются черные металлы (сталь и чугун). Химическая коррозия — разрушение металлов и сплавов в результате окисления при взаимодействии с сухими газами (02, S02 и др.) при высоких температурах или с органическими жидкостями — нефтепродуктами, спиртом и т. п. Электрохимическая коррозия — разрушение металлов и сплавов в воде и водных растворах. Для повышения долговечности и сохранения декоративности металлоконструкции защищают от коррозии. Сущность большинства способов защиты от коррозии — предохранение поверхности метал- ; ла от проникновения в нее влаги и газов путем создания на металле защитного слоя. Существуют и другие методы, например электрохимическая защита, с помощью установки протектора из более активного металла на защищаемую металлоконструкцию. Наиболее простой, но не долговечный метод защиты металла — нанесение на его поверхность водонепроницаемых неметаллических покрытий (битумных, масляных и эмалевых красок). В последние годы все большее применение находит метод защиты от коррозии покрытием металла тонким слоем пластмассы. Защитить металл от коррозии можно также, покрывая его слоем другого более коррозионно-стойкого металла: оловом, цинком, хромом, никелем и др. Защитный слой металла наносят путем цинкования, никелирования, хромирования, лужения и свинцевания. Покрытие цинком используют для защиты от коррозии закладных деталей железобетонных изделий, водопроводных труб, кровельной жести. Защитный слой наносят гальваническим (электролитическим осаждением из раствора солей) или термическим (окунанием в расплав металла или распылением расплава) методом. Применяют химические способы образования покрытий (плотных оксидных пленок) на металле: фосфатирование (для черных металлов) и анодирование (для алюминиевых сплавов). Для получения металлов, хорошо противостоящих коррозии (например, нержавеющей стали), применяют легирование. Так, вводя в сталь хром и никель в количестве 12…20%, получают нержавеющие стали, стойкие не только в водных растворах солей, но и в кислотах. Читать далее: |
|
© 2007 «Строй-сервер. |
© Права защищены. |
Лекция 11. Коррозия металлов и методы защиты от коррозии
Химическая и электрохимическая коррозия. Способы защиты металлов от коррозии
Коррозией называется процесс самопроизвольного разрушения металлов под воздействием внешней среды. Все случаи коррозии принято делать на два вида: химическую и электрохимическую.
Химическая коррозия — это окисление металлов, не сопровождающееся возникновением электрического тока. Примером химической коррозии является образование окалины на железе при высокой температуре без участия электролитов,
Электрохимическая
коррозия — разрушение
металла, обусловленное его окислением
в среде электролита и сопровождающееся
возникновением электрического тока в
результате образования гальванического
элемента, который в этом случае называют
коррозионным гальваническим элементом. Работа коррозионного гальванического
элемента обусловлена разностью
потенциалов активного (анодного) участка
и пассивного (катодного) участка. На
анодных участках коррозионного
гальванического элемента происходит
окисление (растворение) основного
металла
Работа коррозионного гальванического
элемента обусловлена разностью
потенциалов активного (анодного) участка
и пассивного (катодного) участка. На
анодных участках коррозионного
гальванического элемента происходит
окисление (растворение) основного
металла
Анод: Me — Ze = Mez+ .
На катодных участках, в зависимости от состава-среды, может протекать восстановление кислорода, воды или ионов водорода, которые всегда содержатся в воде и растворах, соприкасающихся с воздухом.Коррозия с участием кислорода называется коррозией с кислородной деполяризацией. Она описывается уравнениями:
Анодный процесс: Me — Ze = Mez+
Катодный процесс:
а) в кислой среде (рН < 7)
О2 + 4Н+ + 4ё=2Н2O;
б) в нейтральной и щелочной среде (рН > 7)
О2
+ 2Н2О
+ 4e =
4OH.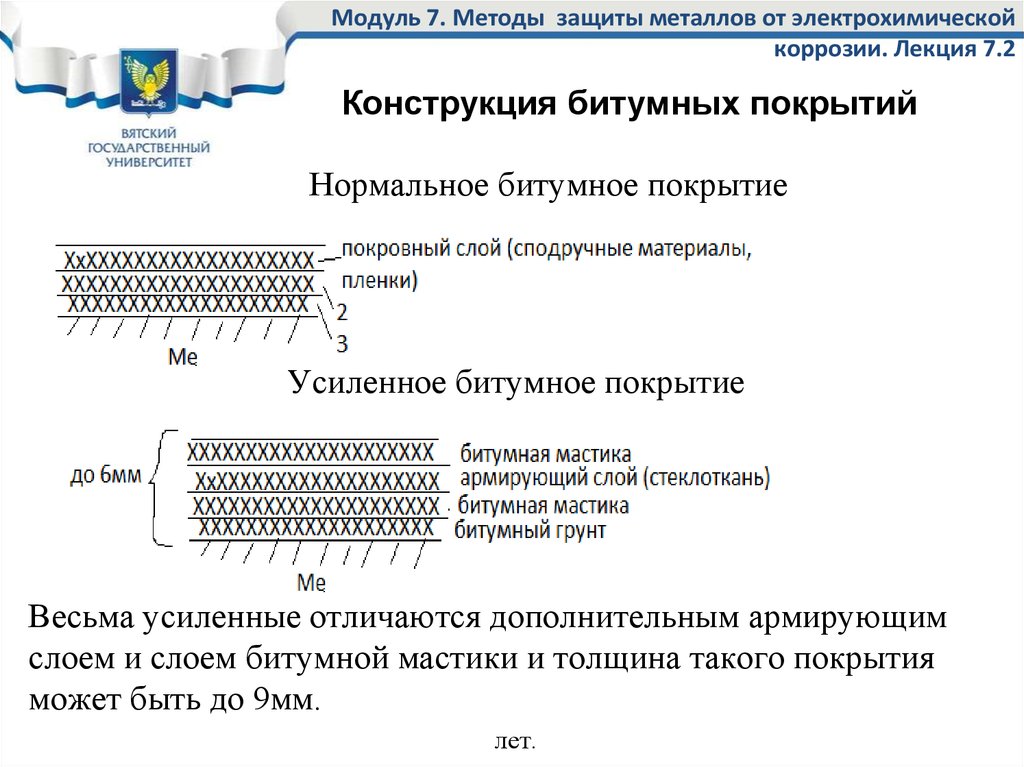
Коррозия, сопровождающаяся выделением водорода на катоде, называется коррозией с водородной деполяризацией и описывается уравнениями:
Анодный
процесс: Me — Z e = Me
Катодный процесс:
а) в кислой среде (рН < 7)
2Н+ + 2e = Н2↑;
б) в нейтральной и щелочной среде (рН ≥ 7)
2H2O + 2e = H2↑ + 2OH..
Таким образом, электрохимическая коррозия возможна при условии, когда электроны с анодных участков постоянно отводятся на катодные, а затем удаляются с них окислителем. Коррозионный гальванический элемент изображают следующим образом:
(A) MI| Н2О/Окислитель(О2 или Н+)| МII (примеси) (К).
Выделяемая иногда в отдельный вид грунтовая (почвенная) коррозия может быть сведена к одному из вышеперечисленных случаев.
Примеры решения задач
Пример
1. Хром
находится в контакте с медью. Какой из
металлов будет окисляться при коррозии,
если эта пара металлов находится в
кислой среде (НСl). Составьте схему
образующегося при этом гальванического
элемента. Какой процесс будет протекать
на катоде?
Хром
находится в контакте с медью. Какой из
металлов будет окисляться при коррозии,
если эта пара металлов находится в
кислой среде (НСl). Составьте схему
образующегося при этом гальванического
элемента. Какой процесс будет протекать
на катоде?
Решение. Исходя из положения металлов в ряду напряжений, находим, что хром более активный металл: (φ0Cr2+/Cr = -0,74 В,φ0Cu2+/Cu = +0,34 В). В образующемся гальваническом элементе он будет выполнять роль анода, а медь — катода:
(А)Сr|Н2О/НС1|Сu(К).
Хромовый анод растворяется, а на медном катоде выделяется водород:
Анод:Сr-3е =Сr3+
Катод: 2Н2+ 2е =Н2↑
Пример 2. Какие процессы протекают при коррозии технического железа в атмосферных условиях?
Решение.
Техническое железо содержит примеси
углерода и некоторых металлов, которые,
как правило, менее активны, чем железо,
и выполняют роль катода в образующемся
гальваническом элементе, основная масса
железа является анодом.
Схема, образующегося гальванического элемента имеет вид
(A)Fe|H2O/O2|Me(K).
При работе гальванического элемента протекают процессы:
Анод:Fе-2е =Fe2+
Катод: 2Н2О + О2 + 4 e — 4ОH.
Вторичные процессы: Fe2+ +2ОH. = Fe(OH)2,
4Fe(OH)2 + О2 + Н2О = 4Fe(OH)3.
На
скорость коррозии влияют как внутренние
факторы (наличие дефектов кристаллической
решетки металла, механические напряжения
и др.), так и внешние: температура, природа
и состав электролита. С повышением
температуры скорость коррозии, как и
большинства химических реакций,
возрастает. Усиливают коррозию
содержащаяся в атмосфере промышленных
городов пыль, SO
2,
СO2
и другие газы. Поэтому в городах коррозия
протекает в 5-10 раз быстрее, чем в сельской
местности. Ионы Сl—,
присутствующие в морской воде, являются
катализаторами коррозии железа и его
сплавов, так как адсорбируясь на
поверхности металла, разрушают или
препятствуют образованию на нем защитных
слоев. Кроме того, скорость коррозии
двух контактирующих металлов будет тем
больше, чем больше разность потенциалов
этих металлов. Полностью предотвратить
процессы коррозии металлов практически
не удается, однако существуют способы
защиты металлов от коррозии.
Поэтому в городах коррозия
протекает в 5-10 раз быстрее, чем в сельской
местности. Ионы Сl—,
присутствующие в морской воде, являются
катализаторами коррозии железа и его
сплавов, так как адсорбируясь на
поверхности металла, разрушают или
препятствуют образованию на нем защитных
слоев. Кроме того, скорость коррозии
двух контактирующих металлов будет тем
больше, чем больше разность потенциалов
этих металлов. Полностью предотвратить
процессы коррозии металлов практически
не удается, однако существуют способы
защиты металлов от коррозии.
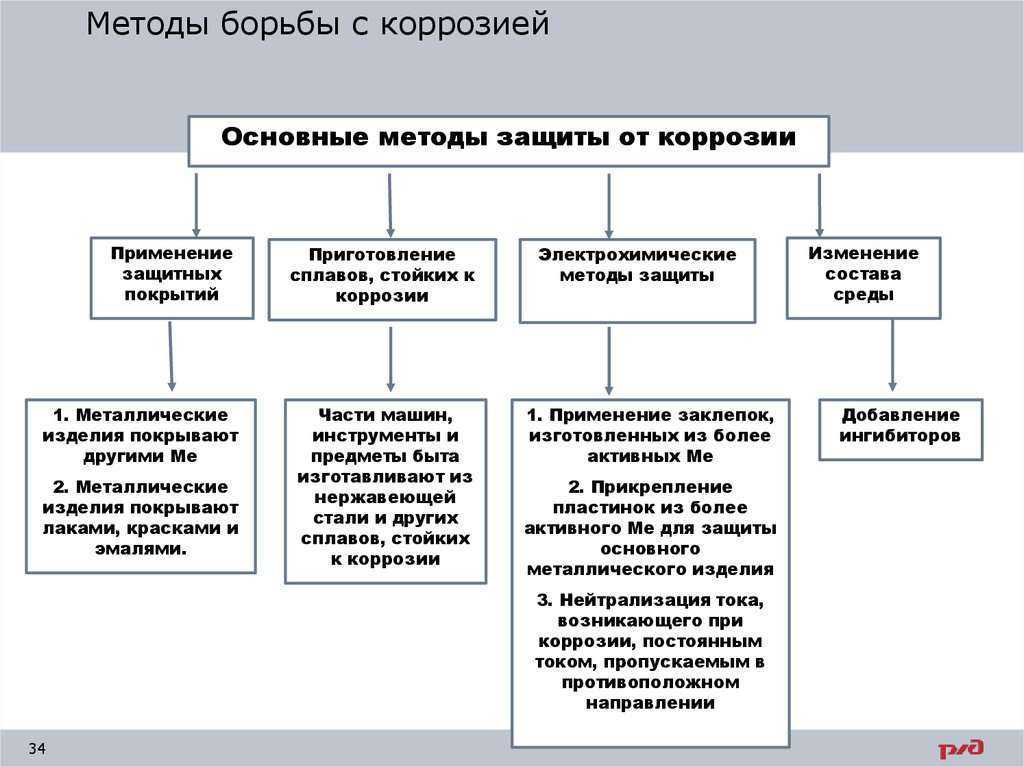
1. Изменение коррозионной среды —
2.
Легирование
металлов. Это
введение в состав сплавов компонентов,
повышающих химическую стойкость.
Наибольшее применение находят нержавеющие
стали, в состав которых входит хром (до
15 %) и никель (до 10 %). Кроме того, в качестве
легирующих компонентов используют
марганец, кремний, вольфрам, молибден,
титан и другие металлы.
Кроме того, в качестве
легирующих компонентов используют
марганец, кремний, вольфрам, молибден,
титан и другие металлы.
3. Неметаллические покрытия. Механически защищают металлы от коррозии, изолируя их от влияния внешней среды. Неметаллические покрытия делятся на неорганические и органические. Из неорганических покрытий наиболее распространены оксидные и фосфатные пленки. Так, при кипячении железа в растворе солей фосфорной кислоты (обычно солей Fe и Мn) получают фосфатные пленки, хорошо защищающие от коррозии в атмосфере. Среди органических, покрытий наиболее распространенными являются масляные краски, лаки, полимерные пленки. Лакокрасочные покрытия — самый дешевый метод защиты от коррозии.
4.
Металлические
покрытия. По
характеру защитного действия различают
анодные и катодные покрытия. Анодным
является
покрытие металлом, электродный потенциал
которого меньше, чем у защищаемого
металла. Покрытие из металла менее
активного (с большим электродным
потенциалом), чем защищаемый металл,
называется катодным. Если покрытие
не нарушено и полностью изолирует
основной металл от воздействия окружающей
среды, принципиального различия между
анодными и катодными покрытиями нет.
При нарушении слоя защищающего металла
возникают коррозионные гальванические
элементы, в которых защищаемый металл
может играть роль или инертного катода,
или активного анода. Так, при нарушении
в атмосферных условиях алюминиевого
покрытия на медном изделии (φ0Al3+/Al=
-1,67 В, φ0 Cu2+/Cu
= +0,34 В) возникает гальванический элемент
(А)А1|Н2О/О2|Cu(К).
Если покрытие
не нарушено и полностью изолирует
основной металл от воздействия окружающей
среды, принципиального различия между
анодными и катодными покрытиями нет.
При нарушении слоя защищающего металла
возникают коррозионные гальванические
элементы, в которых защищаемый металл
может играть роль или инертного катода,
или активного анода. Так, при нарушении
в атмосферных условиях алюминиевого
покрытия на медном изделии (φ0Al3+/Al=
-1,67 В, φ0 Cu2+/Cu
= +0,34 В) возникает гальванический элемент
(А)А1|Н2О/О2|Cu(К).
В этом элементе, покрывающий металл Аl является анодом, он разрушается (окисляется) и, растворяясь, защищает основной металл, несмотря на нарушение целостности покрывающего слоя:
Анод: Аl — 3 е = Аl3+
Катод: 2Н2О + О2 + 4 е = 4ОН.
Катодное же покрытие (например, свинцовое покрытие железа) в аналогичном случае перестает защищать основной металл и, создавая с ним гальванический элемент, усиливает своим присутствием его коррозию:
(А)Fе|Н2О/О2|Рb(К)
Анод: Fe — 2 e = Fe2+
Катод:
Н2О
+ О2
+ 4 е = 4ОН.
5. Электрохимическая защита:
а) катодная защита. Защищаемую конструкцию присоединяют к катоду внешнего источника тока, в результате она становится катодом, не окисляется, на ней идет восстановление компонентов среды. В качестве анода применяют любой металлический лом, ко-торый присоединяют к аноду внешнего источника тока. Таким способом защищают, например, подземные трубопроводы;
б) протекторная защита. Защищаемый металл соединяют с более активным металлом, имеющим меньший электродный потенциал. Последний служит анодом, растворяется и защищает основной металл. Так цинк является протектором для стального корпуса судна:
(А) Zn | Н2О/ О2| Fe (К)
Анод:Zn-2е =Zn2+
Катод: Н2О + О2 + 4e =4ОН.
Для
более активной защиты металлических
конструкций можно совмещать несколько
способов защиты от коррозии, например,
покрытие и катодную электрозащиту.
Методы предотвращения коррозии | Типы коррозии
Эта жидкость может быть или не быть абразивной.
Точечная коррозия При этом типе коррозии эрозия неравномерна по поверхности. металл.
Это связано с тем, что металл находится в стабильной жидкости или низкоскоростном жидкость.
Щелевая коррозия
Эти типы коррозии обычно возникают там, где болты и гайки, соединения внахлестку из-за чего могут возникнуть трещины.
Коррозия ячейки концентрации
Это происходит, когда поверхность находится в электролитической среде, где концентрация агрессивной жидкости или количество растворенного кислорода варьируется.
Графитная коррозия
Это потеря части железа в отливке. железо из-за проживания в соленой воде или кислоте.
Графит остается на месте, а металл становится мягким и
слабый.
Гальваническая коррозия
Это вызвано соединением двух металлов с разными электродными потенциалами в агрессивная электролитическая среда.
В этой коррозии глубокие ямы и на поверхности анодированного металла образуются канавки.
Взаимодействие двух разнородных металлов может привести к гальванической коррозии.
Будет деформироваться только один металл, который будет меньше стабилен и будет находиться внизу на элементарной диаграмме.
Например, если латунь или медь подвергаются воздействию железа, железо начинает разлагаться.
Этот процесс будет продолжаться до полного истощения железа.
Теперь мы узнаем, каковы методы предотвращения коррозии?
Существуют следующие распространенные методы предотвращения коррозии:
- Окраска
- Грунтовка
- Гальваника
- Цинкование
- Хромирование
- Плакирование
- Серебрение
- Позолота
- Никелирование
- Медное покрытие
- Родирование
- Цинкование
- Кадмирование
- Лужение
- Воронение
- Калоризация
Покраска
Роспись металла выполняется как для консервации, так и для украшения.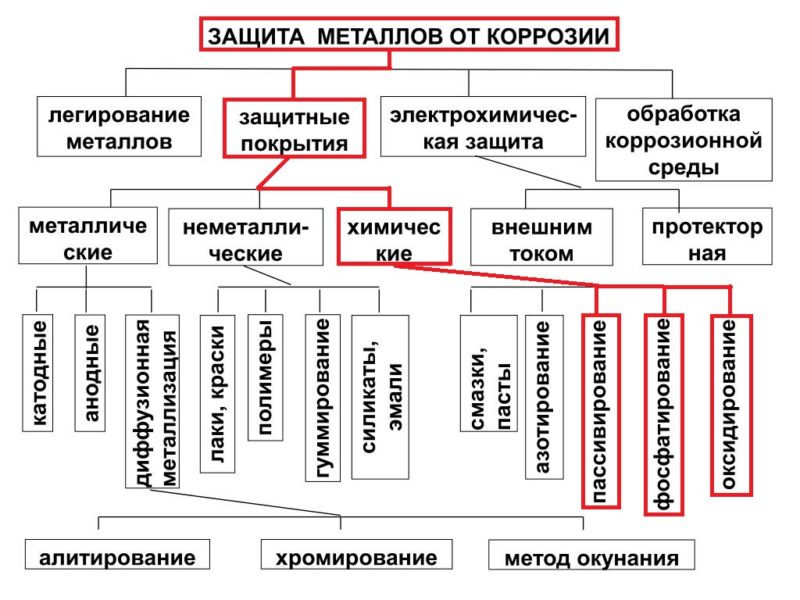
Перед покраской поверхность металла должна быть тщательно очищена от окисления, прокатной окалины, ржавчины, жиров или смазок, пыли и т.п.
Которые должны быть удалены напильником, наждаком, шлифовкой и т.п.
Используемый метод должен не только очищать металл, но и немного травить, чтобы между краской и металлом была хорошая связь.
Грунтовка
Сразу после подготовки и очистки лакокрасочной поверхности очень важно нанести на нее подходящую грунтовку, чтобы на металлической поверхности не было дальнейшего окисления.
В основном для стали используется грунтовка из сурика, сурика или хромата цинка.
Для меди рекомендуется использовать хромат цинка.
Для алюминий и оцинкованное железо, рекомендуется использовать травильный грунт или цинк хромат.
Гальваника
Гальваника – это процесс нанесения одного металла на другой с помощью
гидролиз, предназначенный для защиты от коррозии.
Гальванопокрытие также относится к особому типу, такому как меднение, серебрение и хромирование.
Гальваническое покрытие широко используется в таких отраслях, как производство автомобилей, электроники, ювелирных изделий и т. д.
Этот процесс в основном основан на использовании электролитических элементов.
Он должен дать отрицательный заряд металлу и быть погруженным в раствор, содержащий соль металла (электролит) и имеющий положительно заряженный ион металла.
Тогда за счет отрицательных и положительных заряд, два металла притягиваются друг к другу.
Есть много металлов, которые можно использовать для покрытия.
Следовательно, необходимо выбрать правильный тип электролита.
Некоторые электролиты – кислотно-щелочные, соли металлов или расплавленные соли.
Цинкование
В этом процессе используются цинковые покрытия. на стали или железе, чтобы предотвратить коррозию.
Наиболее распространенным методом является горячее погружение, при котором деталь погружается в ванну с
расплавленный цинк.
Оцинковка защищает нижний чугун или сталь в следующие основные способы:
1. Неповрежденное цинковое покрытие не пропускает коррозионно-активный материал переходить к стали или железу.
2. Цинк действует как расходуемый анод, который сохраняет оставшийся цинк из открытой стали, даже если есть царапина на покрытии.
3. Для достижения лучших результатов нанесение хроматов на цинк рассматривается как индустриальное направление.
Хромирование
Хромирование – это гальванический процесс, какая хромовая кислота, называемая шестивалентным хромом, используется.
Хромирование часто используется в декоративных целях, но также повышает устойчивость к коррозии и трению.
Плакирование
Плакирование — это соединение двух разнородных металлов. Это отличается от сварки или склеивания.
Это делается путем удаления двух металлов из красителя и прессования или
прокатка листов под высоким давлением.
Серебряное покрытие
Это процесс, при котором проводящая поверхность покрывается серебром для предотвращения коррозии и одновременного придания блестящего блеска.
Серебрение бывает разных видов, от матового до блестящего и полублестящего.
В то время как некоторые покрытия могут быть выполнены без хромата, другие используют хромат.
Также возможно покрытие чистым серебром. Самый распространенный серебрение используется для украшения украшений, тарелок, кубков и др. трофеи.
Результатом этого процесса является хорошая полировка поверхности покрытия.
Позолота
Золото известно своей высокой стойкостью окислению и электропроводности.
Этот процесс часто
используется для улучшения проводимости электрических разъемов, таких как ювелирные изделия и
части электроники.
Никелирование
Никель – известный материал для покрытия.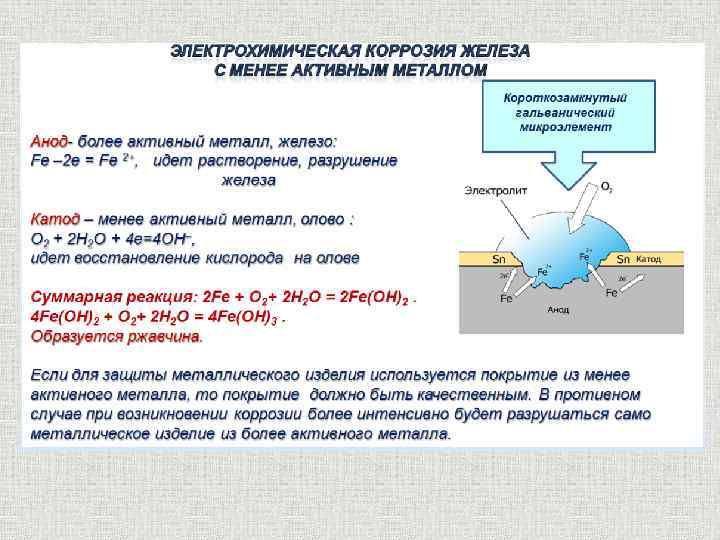 Это используется для
хорошая декоративная и коррозионная стойкость.
Это используется для
хорошая декоративная и коррозионная стойкость.
Обычно используется для нанесения покрытий на предметы домашнего обихода, такие как дверные петли, ножи и душевые принадлежности.
Меднение
Меднение также известно металлическое покрытие в применениях, требующих высокой проводимости по низким ценам.
Он известен тем, что наносит покрытие на электронные компоненты, такие как печатные платы.
Медь – один из самых дешевых металлов для покрытия из-за
благодаря высокой эффективности покрытия и низкому потреблению материала
цена.
Родирование
Родий – это разновидность платины, которая устойчива к царапинам и придает поверхности блеск.
Покрытие родием используется в ювелирном производстве, особенно там, где есть необходимость сделать покрытие из белого золота.
Цинковое покрытие
Цинкование часто используется в автомобильной промышленности.
Цинковое покрытие противостоит окислению и
коррозия.
Автомобильные доски и другие металлические детали, такие как гайки и болты, крепеж, автомобильные детали оцинкованы.
Кадмирование
Кадмирование улучшает адгезию, смазывающую способность и коррозионную стойкость.
Толщина кадмиевого покрытия обеспечивает достаточный износ защиты, несмотря на то, что он очень маленький.
Кадмий можно эффективно покрывать практически все токопроводящие металлы.
Лужение
Лужение эффективно в тех случаях, когда требуется нетоксичность, высокая пластичность, хорошая растворимость и повышенная устойчивость к коррозии.
Эти преимущества полезны для электронная промышленность и пищевая промышленность.
Воронение
Воронение используется для создания защитного покрытия на стали. часть.
Процесс окисления обеспечивает некоторую защиту от коррозия.
Полученное покрытие придает материалу синий или иссиня-черный цвет
наружной поверхности металла в зависимости от заданного технологического процесса.
Для этого сталь нагревают до 315°С селитрой поташа (селитры) и погружают в расплавленный раствор.
сталь выдерживается в растворе от 1 до 15 минут, в зависимости от цвета и глубины обязательный.
Калоризация
В этом процессе для предотвращения коррозии используется алюминиевый порошок.
Алюминиевое покрытие выполнено путем нагревания железа или стали в смеси алюминия и глинозема.
Итак, здесь я обсуждал какие есть методы предотвращения коррозии и также виды коррозии надеюсь вам понравится Эта тема.
Спасибо.
Что такое коррозия и как ее предотвратить? — Судовые покрытия
Слово «коррозия» происходит от латинского «corrodere», что переводится как «грызть на куски». Для морских применений мягкая сталь остается металлом номер один для конструкционных целей, ее главный недостаток заключается в том, что она легко подвергается коррозии в морской воде. Предотвращение коррозии требует устранения или подавления с помощью катодной защиты и/или покрытий. Ремонт покрытия на море может стоить до 100 раз дороже первоначального покрытия, поэтому стоит сделать все правильно с первого раза.
Предотвращение коррозии требует устранения или подавления с помощью катодной защиты и/или покрытий. Ремонт покрытия на море может стоить до 100 раз дороже первоначального покрытия, поэтому стоит сделать все правильно с первого раза.
Что такое коррозия?
Коррозия — это естественный процесс, при котором материалы, обычно металлы, движутся к своему наинизшему возможному энергетическому состоянию, что приводит к самопроизвольной реакции между материалом и окружающей средой, что приводит к деградации этого материала. Слово происходит от латинского « corrodere» , что переводится как «грызть на куски».
Для морских применений мягкая сталь остается металлом номер один в конструкционных целях благодаря ее относительно низкой стоимости, механической прочности и простоте изготовления. Его главный недостаток заключается в том, что он легко подвергается коррозии в морской воде и, если его не защитить должным образом, быстро теряет прочность, что может привести к разрушению конструкции. На приведенной ниже диаграмме показан цикл коррозии. От добычи оксида железа, производства стали до коррозии.
На приведенной ниже диаграмме показан цикл коррозии. От добычи оксида железа, производства стали до коррозии.
Изображение: ResearchGate
Ремонт морских покрытий может в 100 раз превышать стоимость первоначального покрытия, а по оценкам NACE International общая стоимость морской коррозии составляет от 50 до 80 долларов США. миллиардов каждый год. Источник: Морская промышленность. 2018. Морская промышленность. [ОНЛАЙН] Доступно по адресу: https://www.nace.org/Corrosion-Central/Industries/Maritime-Industry/ .
При правильном планировании судовладельцы могут гарантировать, что их суда работают с максимальной производительностью и сохраняют экономическую эффективность, сохраняя при этом состояние своих активов. Если причиной износа стала плохая подготовка поверхности, то единственное решение — удалить краску и начать заново. Стоит сделать это правильно с первого раза.
Два типа коррозии, особенно актуальные для морской промышленности, — это точечная коррозия и бактериальная коррозия.
Как предотвратить коррозию
Для предотвращения коррозии необходимо устранить или подавить ее двумя основными методами: катодной защитой и покрытиями . Как правило, системы катодной защиты используются в сочетании с системами покрытий.
Катодная защита
Целью катодной защиты является подавление протекающей электрохимической реакции. В нормальных коррозионных условиях протекание тока от анода приводит к потере металла на анодном участке, что приводит к защите металла на катодном участке.
Защиту можно обеспечить, сделав структуру, которую вы хотите защитить, катодной, используя два метода:
- Защитные аноды:
Когда два разнородных металла погружаются в морскую воду, металл с наименьшим электрическим потенциалом подвергается наибольшей коррозии. Например, скорость коррозии мягкой стали можно контролировать, соединив ее с цинком, поскольку в этом случае он станет анодом и будет подвергаться коррозии. В этом примере цинковый анод обозначается как расходуемый анод , потому что он медленно расходуется (корродирует) в процессе защиты.
Например, скорость коррозии мягкой стали можно контролировать, соединив ее с цинком, поскольку в этом случае он станет анодом и будет подвергаться коррозии. В этом примере цинковый анод обозначается как расходуемый анод , потому что он медленно расходуется (корродирует) в процессе защиты.
Еще одно применение цинка в качестве расходуемого анода — цинковое покрытие стали; либо в форме гальванизации или металлизации, либо в краске, которая содержит высокие уровни активного цинка.
- Системы токов под давлением:
Корпус судна можно сделать катодным с помощью источника постоянного тока. Приложенный ток применяется в противоположном направлении, чтобы нейтрализовать ток коррозии и преобразовать корродирующий металл из анода в катод. В этом примере отрицательный вывод постоянного тока подключен к защищаемому трубопроводу. Анод остается внутри, чтобы увеличить электрический контакт с окружающей средой.
Изображение: Основные принципы катодной защиты
COALINGS
рабочая среда.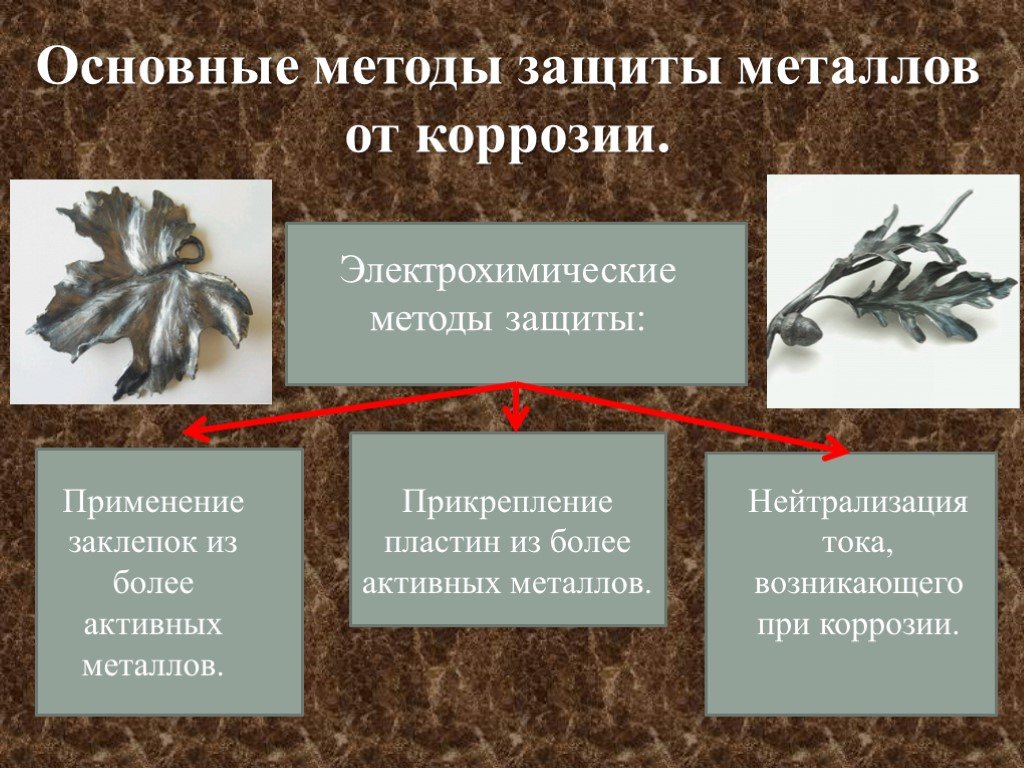
Низкая проницаемость и хорошая «мокрая адгезия», то есть адгезия при погружении, считаются наиболее важными аспектами защиты от коррозии с помощью покрытий.
- Адгезия
Для максимальной адгезии покрытий стальные поверхности перед окраской должны быть чистыми, сухими и свободными от масла, ржавчины, солей и других загрязнений.
- Проницаемость
Сильно сшитые, химически отверждаемые системы, вероятно, будут иметь относительно низкие характеристики проницаемости, и на это может повлиять толщина пленки. Как правило, более толстые пленки задерживают прохождение кислорода и воды к поверхности стали. Таким образом, пленка с большой толщиной (>400 мкм сухой пленки) может обеспечить высокую степень защиты от коррозии, которая лучше всего достигается в многослойных системах, а не в однослойном.
- Поврежденное покрытие s
Покрытия в процессе эксплуатации могут подвергаться механическим повреждениям. Таким образом, сохранение защиты от коррозии лучше всего достигается за счет использования покрытий, которые обеспечивают как стойкость к истиранию, так и защиту от коррозии. Рекомендуется, чтобы покрытия имели хорошую стойкость к «подрезанию», т. е. стойкость к ползучести под пленочной коррозией на поврежденных участках.
Таким образом, сохранение защиты от коррозии лучше всего достигается за счет использования покрытий, которые обеспечивают как стойкость к истиранию, так и защиту от коррозии. Рекомендуется, чтобы покрытия имели хорошую стойкость к «подрезанию», т. е. стойкость к ползучести под пленочной коррозией на поврежденных участках.
Другие механизмы, используемые для предотвращения коррозии в непогруженных надводных зонах, включают:
- Использование антикоррозионных пигментов, таких как фосфат цинка. Этот пигмент малорастворим и может образовывать молекулярный слой, препятствующий коррозии, на поверхности стали.
- Использование металлического цинка в качестве расходуемого пигмента, по сути, разработка системы катодной защиты «на месте».
Наш успех в предотвращении коррозии:
Многие клиенты AkzoNobel добились успеха в предотвращении коррозии с помощью Intershield 300. Подробнее:
- « Samco Raven» взлетает с Intershield 300 после 15 лет эксплуатации .


 Для развития коррозии достаточно, чтобы металл был просто покрыт тончайшим слоем адсорбированной воды (влажная поверхность). Из-за неоднородности строения металла при электрохимической коррозии в нем образуются гальванические пары (катод — анод) между зернами (кристаллами) металла, отличающимися одно от другого химическим составом, например между зернами феррита и цемента. Атомы металла с анода переходят в раствор в виде катионов. Эти катионы, соединяясь с анионами, содержащимися в растворе, образуют на поверхности металла слой ржавчины. В основном металлы разрушаются от электрохимической коррозии.
Для развития коррозии достаточно, чтобы металл был просто покрыт тончайшим слоем адсорбированной воды (влажная поверхность). Из-за неоднородности строения металла при электрохимической коррозии в нем образуются гальванические пары (катод — анод) между зернами (кристаллами) металла, отличающимися одно от другого химическим составом, например между зернами феррита и цемента. Атомы металла с анода переходят в раствор в виде катионов. Эти катионы, соединяясь с анионами, содержащимися в растворе, образуют на поверхности металла слой ржавчины. В основном металлы разрушаются от электрохимической коррозии.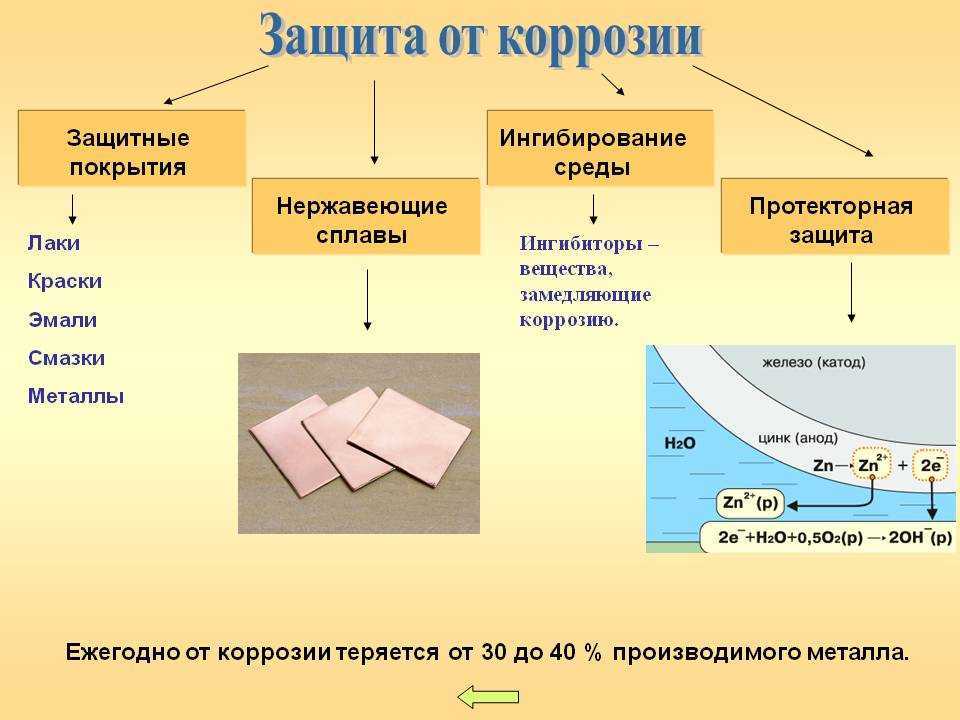

 ру». — информационная система по ремонту и строительству.
ру». — информационная система по ремонту и строительству.