Основные функции белков в организме, их свойства и роль
Поможем понять и полюбить химию
Начать учиться
Генетическая информация о структуре и функциях всех белков в организме передается нам от родителей с помощью специальных белков. К тому же эти вещества определяют структуру и форму клетки, обеспечивают узнавание и связывание различных молекул, а также катализ и регуляцию химических реакций, протекающих в наших телах. И это все еще неполный список функций белков в организме человека!
Что такое белки
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью.
Этот класс органических веществ можно рассматривать с точки зрения двух наук: биологии и химии. Начнем с биологической роли белков.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Биологические функции белков
Строительная, или пластическая
Белки являются основой структурного материала всех клеточных мембран, так как образуют основу протоплазмы любой живой клетки. Наверняка вам известны такие белки, как коллаген, кератин и эластин. Именно они составляют основу соединительной ткани организма и обеспечивают ее прочность.
Транспортная
Эта функция заключается в присоединении химических элементов или биологически активных веществ, то есть гормонов, и в перемещении их к различным тканям и органам тела. Например, гемоглобин является переносчиком кислорода в крови, а также принимает участие в транспорте углекислого газа. Перенос насыщенных жирных кислот в крови по организму происходит при участии альбумина. Трансферрин переносит ионы железа, а особые белки участвуют в переносе ионов натрия и калия через мембрану клетки.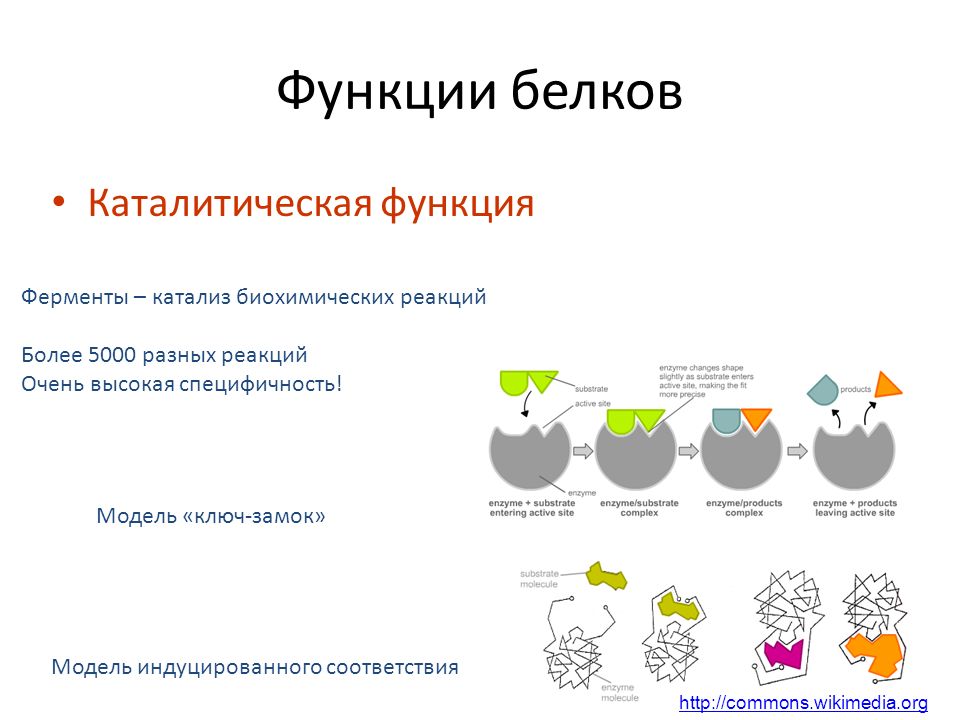
Регуляторная
Белки играют роль в регуляции и согласовании обмена веществ в различных клетках организма. Например, инсулин регулирует уровень глюкозы в крови, а также увеличивает образование жиров из углеводов.
Защитная
При попадании в организм чужеродного белка или микроорганизма образуются особые белки — антитела. Защитой организма от чрезмерной кровопотери является превращение белка фибриногена. Конечно, в этом процессе участвуют и другие белки, например тромбин, а также множество других факторов свертывания. Защиту нашего желудка от воздействия сильнокислой среды обеспечивает белок муцин, основу кожи составляет коллаген, а кератин является белком защитного волосяного покрова.
Двигательная
Двигательную функцию обеспечивают специальные сократительные белки, например актин и миозин, которые участвуют в сокращении скелетных мышц.
Сигнальная
В поверхность мембраны клетки встроены рецепторы (молекулы белков), которые в ответ на воздействие внешней среды способны изменять свою структуру, передавая команды в клетку.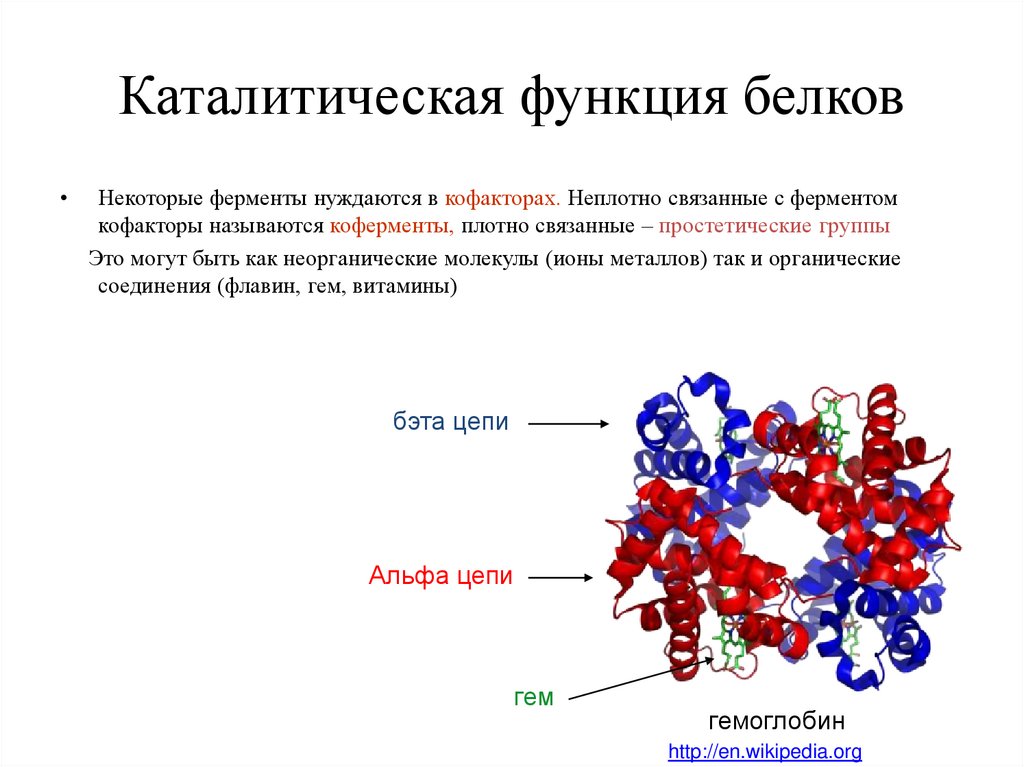
Запасающая
Белки способны образовывать запасные отложения — правда, в организме животных белки, как правило, не запасаются. Но на каждое правило всегда найдется исключение — это альбумин, который содержится в яйцах, и казеин молока. Благодаря белкам в организме могут откладываться, например, ионы железа, которые впоследствии образуют комплекс с белком ферритином.
Энергетическая
Белки могут распадаться в клетке до составляющих, то есть до аминокислот. Часть этих аминокислот подвергается расщеплению, в ходе которого высвобождается энергия. При расщеплении 1 грамма белка выделяется 17,6 кДж, или 4,2 ккал, энергии. Но в этой роли белки используются крайне редко.
Каталитическая
Белки, которые называются ферментами, способны ускорять биохимические реакции, происходящие в клетке, — в этом заключается каталитическая функция белков.
Питательная, или резервная
Эту функцию выполняют резервные белки, которые являются источником питания для плода. Такими белками могут быть казеин — белок молока, овальбумины — белки яйца, проламины и глютелины — белки растений.
Такими белками могут быть казеин — белок молока, овальбумины — белки яйца, проламины и глютелины — белки растений.
Функция антифриза
Антифризные белки способны понижать температуру замерзания раствора в клетках, чтобы предупредить замерзание в условиях низких температур.
Белки как класс органических соединений
А теперь рассмотрим белки с точки зрения химии. В состав белков живых организмов входит только 20 типов аминокислот. Все они являются альфа-аминокислотами, а состав белка и порядок соединения аминокислот друг с другом определяется индивидуальным генетическим кодом.
Перед нами пример альфа-аминокислоты, которая называется альфа-аминопропановой. В строении аминокислоты можно выделить две функциональные группы: карбоксильную (—СООН), которая отвечает за кислотные свойства, и аминогруппу (—NH2), которая, в свою очередь, отвечает за основные свойства.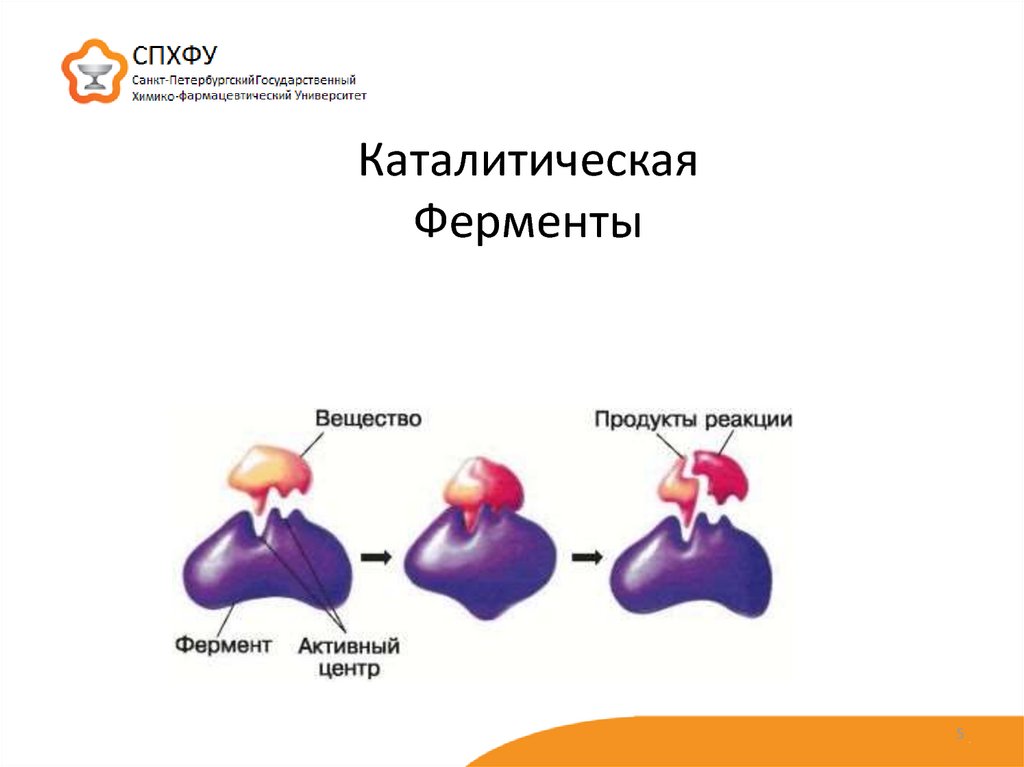
Отсюда можно сделать вывод, что все аминокислоты являются амфотерными соединениями и способны реагировать друг с другом по разным функциональным группам с образованием пептидной связи:
Химические свойства белков очень ограниченны. Давайте их рассмотрим.
Гидролиз
Все белки способны вступать в реакцию гидролиза. В общем виде данная реакция выглядит следующим образом:
Белок + nH2O = смесь из α-аминокислот.
Денатурация
Денатурация — это разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры.
Напомним виды структур белка:
The image is a derivative of «Protein structure vector illustration» by VectorMine on Shutterstock.
Денатурация может быть обратимой, а может быть необратимой:
-
обратимая денатурация:
-
необратимая денатурация:
Как видно из условий, обратимость зависит от условий протекания реакций.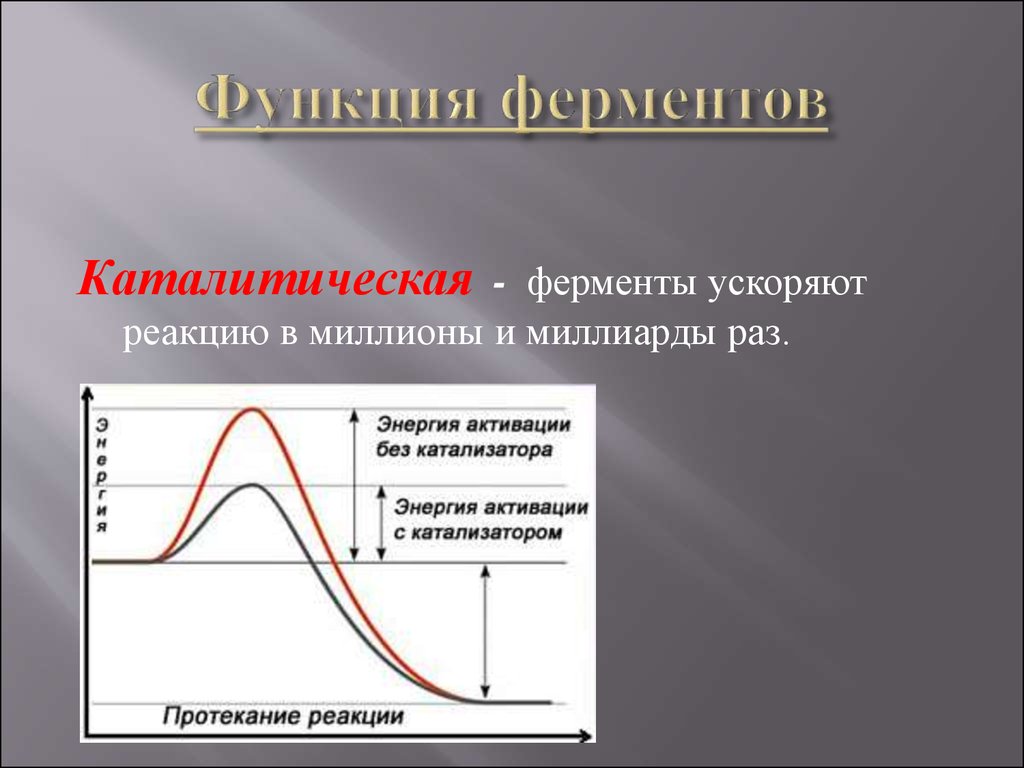 Чем они жестче, тем меньше вероятность обратимости реакции.
Чем они жестче, тем меньше вероятность обратимости реакции.
Биуретовая реакция (качественная реакция на белок)
Раствор белка + NaOH(10%-й р-р) + CuSO4 = фиолетовое окрашивание.
Ксантопротеиновая реакция (качественная реакция на белок)
Растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
Раствор белка + HNO3 (конц) = желтое окрашивание.
Реакция Фоля (цистеиновая проба)
Эта реакция является качественной для аминокислот, содержащих серу:
Белок + (CH3COO)2Pb + NaOH = PbS + черное окрашивание.
Вопросы для самопроверки
-
Какая из структур белка является самой прочной?
-
Первичная
-
Вторичная
-
Третичная
-
Четвертичная
-
-
Какую из перечисленных функций способен выполнять белок?
-
Результативную
-
Регуляторную
-
Регулятивную
-
Растворную
-
-
За счет какой связи образуется первичная структура белка?
-
Ионной
-
Водородной
-
Пептидной
Ковалентной неполярной
-
-
При гидролизе белка получается (получаются).
 ..
.. -
Аминокислоты, образующие этот белок
-
Углекислый газ
-
Аминокислота и вода
-
Белок гидролизу не подвергается
-
-
Какая реакция с белком дает фиолетовое окрашивание?
-
Ксантопротеиновая
-
Цистеиновая
-
Биуретовая
-
Денатурация
-
Еще больше наглядных примеров функций белков в клетках живых организмов — на онлайн-курсах химии в Skysmart.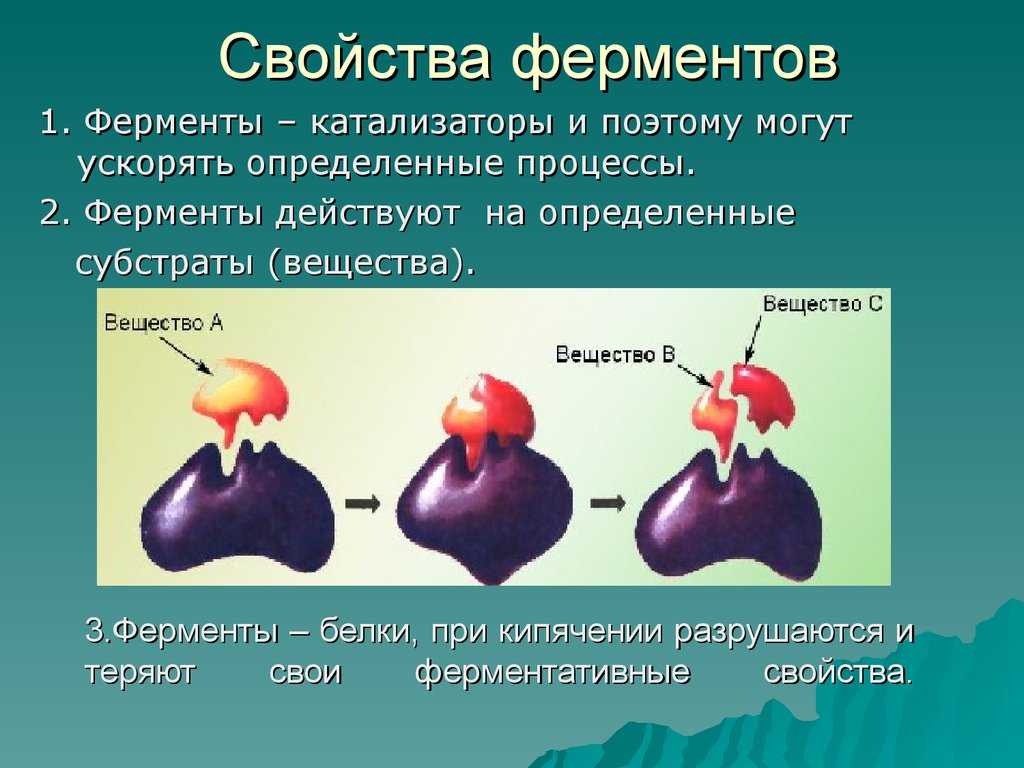 Мы поможем полюбить предмет, разобраться в непонятных темах, улучшить оценки в школе и подготовиться к государственным экзаменам. Выберите подходящий курс и начните учиться с удовольствием!
Мы поможем полюбить предмет, разобраться в непонятных темах, улучшить оценки в школе и подготовиться к государственным экзаменам. Выберите подходящий курс и начните учиться с удовольствием!
Ответы на вопросы
-
a
-
b
-
c
-
a
-
c
К предыдущей статье
Алканы
К следующей статье
Реакции обмена и химические уравнения для них
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Каталитическая функция белков и синтетическая теория эволюции
Похожие презентации:
Строение и функции белков.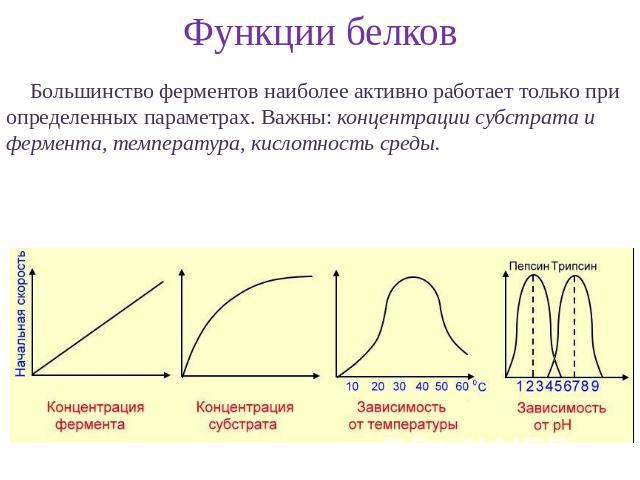 Ферменты
Ферменты
Синтетическая теория эволюции
Состав, строение и функции белков
Синтетическая теория эволюции
Введение в биохимию. Строение и функции белков
Белки. Строение белков. Классификация. Функции белков
Неодарвинизм и зарождение синтетической теории эволюции
Строение и функции белков. (лекция1)
Белки. Функции белков
Синтетическая теория эволюции
1. Презентация по биологии. Каталитическая ф-ия белков и Синтетическая теория эволюции
Презентации Кручинина Артема 105 агрофак2. Вопрос 13- Каталитическая ф-ия белков
1.Определение белка (protein).• Белки – органические биополимеры, мономерами которых являются
20 аминокислот
• Незаменимыми для здорового человека являются 10 аминокислот:
валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и
фенилаланин, аргинин,гистидин.Для запоминания есть правило: Лиза
Метнула Фен в Трибуну, Трезвый Лейтенант Валялся в Изоляторе с
Аргентинским Гитаристом.
• Длина белка может составлять от 50 до 1500 аминокислот,
соединенных между собой пептидной связью в первичной структуре,
водородными во вторичной, дисульфидными связями в третичной, а
также стабилизация самой молекулы идет за счет ионных и
гидрофобных взаимодействий.
3. Типы белков
• Белки также делятся на фибриллярные и глобулярные.• ГЛОБУЛЯРНЫЕ БЕЛКИ — белки, полипептидные цепи к-рых свёрнуты в
компактные сферические структуры (глобулы). Важнейшие представители Г.
б.— альбумины, глобулины, гистоны. Г. б. выполняют динамические
функции. К Г. б. относятся почти все известные ферменты, антитела, нек-рые
гормоны и мн. транспортные белки.. Большинство полярных боковых групп
аминокислотных остатков полипептидных цепей Г. б. находится на
поверхности глобул в гидратир. состоянии, а гидрофобные группы скрыты
внутри глобул, поэтому Г. б. растворимы в полярных растворителях.
• Фибриллярные белки — белки, имеющие вытянутую нитевидную структуру.
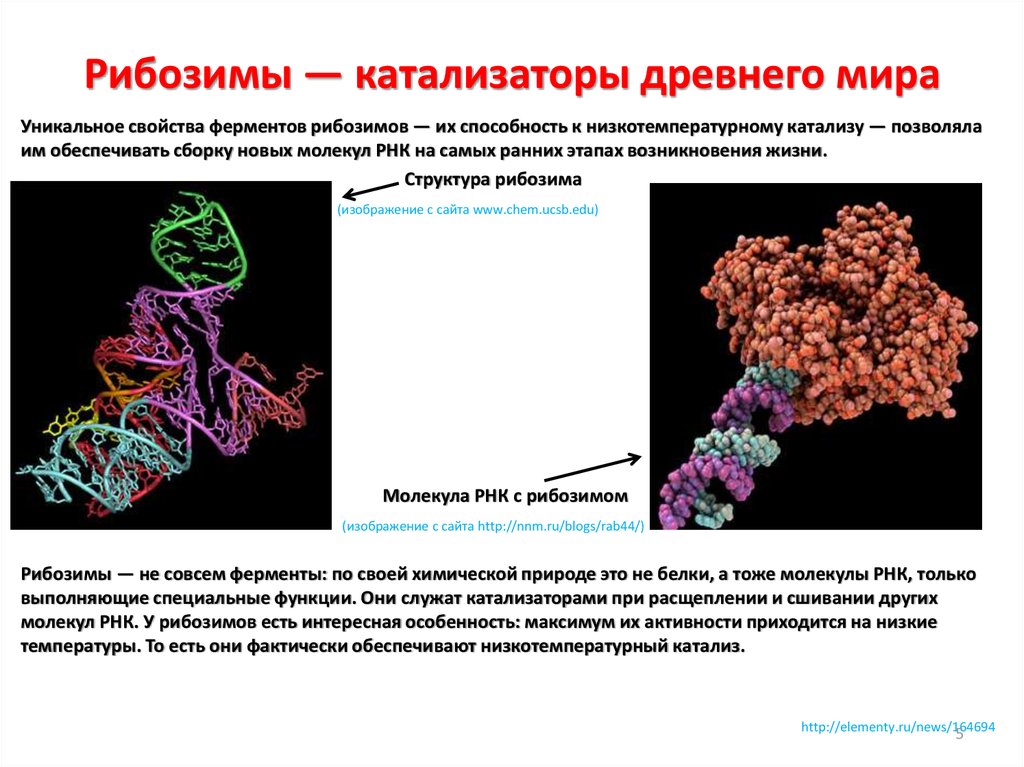
Большинство фибриллярных белков не растворяется в воде, имеет большую
молекулярную массу и высоко регулярную пространственную структуру,
которая стабилизируется, главным образом, взаимодействиями между
различными полипептидными цепями. Играют главным образом опорную
или защитную роль в организме.
4. Катализ белков
• Катализ- возбуждение химической реакции илиизменение ее скорости катализаторами, которые
взаимодействуют с реагентами, но в р-ии не
расходуются.
• Катализ разнообразных химических веществ – это
самая главная функция белков. Подобные процессы
осуществляются ферментами. Каждый из подобных
веществ может осуществлять одну или же
несколько похожих реакций. Катализируют
ферменты процесс расщепления сложных молекул,
а также их синтез. По-другому эти реакции
называют катаболизмом и анаболизмом.
Каталитическая функция белков подразумевает
также репарацию и репликацию ДНК, а также
матричный синтез РНК(ДНК синтетаза и РНК
синтетаза аналогично).
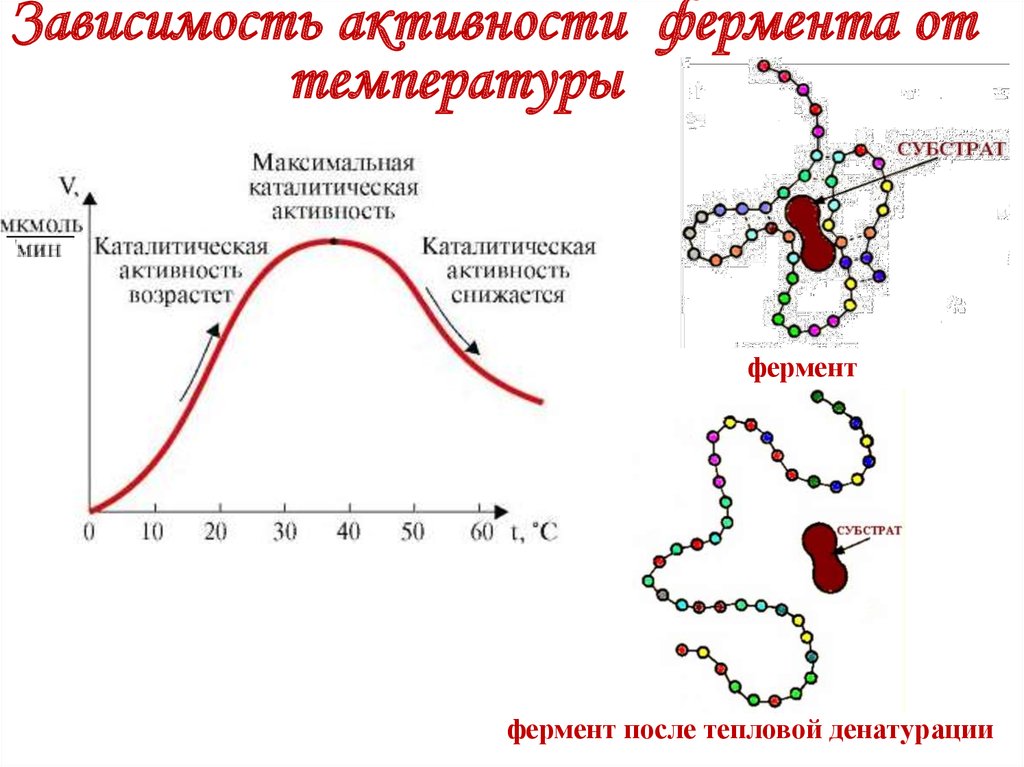
Ферменты работают
в узком тепловом
диапозоне, а также
узком диапозоне рН.
5. Примеры ферментативных реакций
• С помощью бактерий Clostridiumacetobutylicum Х. Вейцман осуществил
ферментативное превращение крахмала
в ацетон и бутиловый спирт. Этот способ
получения ацетона широко
использовался в Англии во время Первой
мировой войны.
• Во время Второй мировой войны с его
помощью в СССР изготавливали
бутадиеновый каучук. Применение
ферментов, продуцируемых
микроорганизмами, для синтеза
пенициллина, а также стрептомицина и
витамина B12.
• Этиловый спирт, получаемый
ферментативным путем, широко
используют в качестве автомобильного
топлива.
Хаим Вейцман (1874-1952гг).
Заслуженный химик
британской империи , и
первый президент Израиля
6. Вопрос 67: Синтетическая теория эволюции
• Синтетическая теория эволюции быларазработанна в 40-хх годы ХХ века.В ее
разработку внесли вклад такие значимые
люди науки как С.
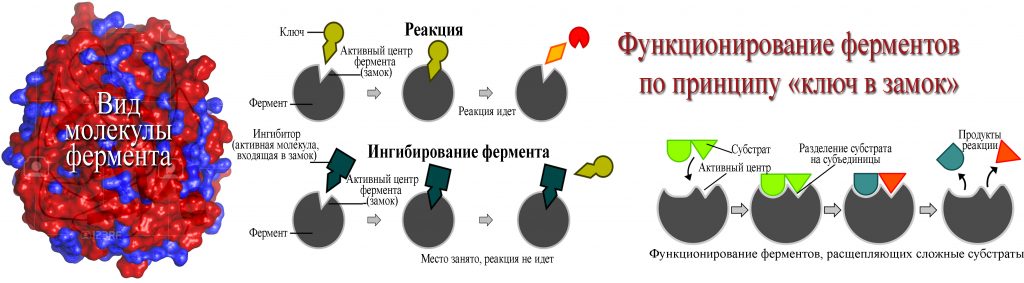 С Четвериков,
С Четвериков,Н.В.Тимофеев-Ресовский, Н.И.Вавиов,
Дж.Хаксли, Дж.Холдейном.
• Идеи неодарвинизма заложены в 1926г.
Сергей Сергеевич Четвериковым, на
западе считается , что был основан С.
Райтом(Совместно с Р. Фишером и Дж.
Холдейном создал математический
аппарат популяционной генетики. Открыл
коэффициент инбридинга и методы его
расчёта. Распространив эту работу на
популяции, пришёл к модели дрейфа
генов.)
С.С.Четвериков 1880-1959гг.
Работы Четверикова, особенно его основной
труд «О некоторых моментах эволюционного
процесса с точки зрения современной генетики»
(1926г), легли в основу синтетической теории
эволюции.
7. Основные постулаты СТЭ
1. Материалом для эволюции служит очень мелкиеизменения наследственности- мутации. Мутационная
изменчивость – поставщик материала для отбора – носит
случайный ненаправленный характер.
2. Основным движущим фактором является естественный
отбор, возникающий на основе борьбы за существование.
3. Наименьшей эволюционной единицей является популяция
4. Дивергентный характер эволюции – один таксон может
стать предком нескольких дочерних таксонов, но каждый
вид имеет только один предковый вид, предковую
популяцию.
5. Видообразование носит последовательный и медленный
характер, представляющий смену одной популяции на
другую.
6. Вид состоит из множества соподчиненных морфологических,
физиологических, экологически, биохимически и генетически отличных, но
репродуктивно не изолированных единиц-популяций, подвидов, демов
(небольшая по численности популяция особей , которая существует
внутри вида на протяжении неск. Поколений, а затем объединяется с
другими подобными популяциями).
7. Вид существует как целостное и замкнутое образование- целостность
8.Т.к основные критерии вида его репродуктивная изоляция, то этот критерий
не применим к формам без полового процесса.

9.Для макроэволюции ( эволюция надвидовая) , характерны такие же
механизмы , что и для микроэволюции ( внутри вида).
10.Любой реальный (не сборный)таксон имеет монофилетическое
происхождение (от одного общего предка) .
11.Эволюция имеет ненаправленный характер и не идет к какой-то
конкретной цели.
English Русский Правила
DOE объясняет…Катализаторы | Министерство энергетики
Офис Наука
Реальный катализатор (фоновое изображение) и схема каталитического этапа (переднее изображение). Реагирующие молекулы (слева) приобретают энергию, чтобы преодолевать энергетический барьер и превращаться в молекулы продукта (справа).
Изображение предоставлено Аргоннской национальной лабораторией
Катализатор — это вещество, которое ускоряет химическую реакцию или снижает температуру или давление, необходимые для ее запуска, при этом само не расходуется во время реакции. Катализ — это процесс добавления катализатора для облегчения реакции.
Катализ — это процесс добавления катализатора для облегчения реакции.
Во время химической реакции связи между атомами в молекулах разрываются, перестраиваются и перестраиваются, рекомбинируя атомы в новые молекулы. Катализаторы делают этот процесс более эффективным, снижая энергию активации , которая представляет собой энергетический барьер, который необходимо преодолеть для того, чтобы произошла химическая реакция. В результате катализаторы облегчают разрыв атомов и образование химических связей для образования новых комбинаций и новых веществ.
Использование катализаторов приводит к более быстрым и энергоэффективным химическим реакциям. Катализаторы также обладают ключевым свойством, называемым 
За последние несколько десятилетий ученые разрабатывали все более специализированные катализаторы для важных реальных приложений. В частности, мощные катализаторы изменили химическую промышленность. Эти достижения привели к созданию биоразлагаемых пластиков, новых фармацевтических препаратов и экологически безопасных видов топлива и удобрений.
Департамент науки Министерства энергетики США: вклад в исследование катализаторов
Программа фундаментальных энергетических наук Департамента энергетики (DOE) активно поддерживает фундаментальные исследования катализаторов. Министерство энергетики занимается разработкой новых катализаторов и использованием катализаторов для контроля химических превращений на молекулярном и субмолекулярном уровнях. В исследованиях Министерства энергетики особое внимание уделяется пониманию этих реакций и тому, как сделать их более эффективными и целенаправленными. Главной целью Министерства энергетики является разработка новых концепций катализа и новых катализаторов, которые помогут промышленности более эффективно и устойчиво производить топливо и химикаты из ископаемого и возобновляемого сырья. Это исследование помогает продвигать солнечное топливо, которое компании производят, используя солнце и обычные химические вещества, такие как углекислый газ и азот. Это исследование также создает передовые методы преобразования выброшенного пластика в новые продукты.
Это исследование помогает продвигать солнечное топливо, которое компании производят, используя солнце и обычные химические вещества, такие как углекислый газ и азот. Это исследование также создает передовые методы преобразования выброшенного пластика в новые продукты.
Краткие факты
- Люди используют катализаторы тысячи лет. Например, дрожжи, которые мы используем для приготовления хлеба, содержат ферменты, которые являются природными катализаторами, способствующими превращению муки в хлеб.
- Нобелевская премия по химии 2005 года была присуждена трем исследователям (Иву Шовену, Роберту Х. Граббсу и Ричарду Р. Шроку) за их работу над катализаторами метатезиса. доктора Граббс и Шрок частично финансировались Министерством энергетики за свои исследования, получившие Нобелевскую премию. Доктор Шрок продолжает финансироваться Министерством энергетики.
- Нобелевская премия по химии 2018 года была присуждена Фрэнсис Х. Арнольд за ее новаторскую работу по управлению эволюцией ферментов для таких приложений, как возобновляемые виды топлива, безвредные для окружающей среды.
 Она частично финансируется Министерством энергетики.
Она частично финансируется Министерством энергетики. - Посетите Аргоннскую национальную лабораторию, чтобы узнать еще о семи вещах, которые вы, возможно, не знали о катализе.
Ресурсы
- Программа BES Управления науки Министерства энергетики США
- Узнайте о направлениях исследований Министерства энергетики США в области химических катализаторов.
- Отчет: Потребности в фундаментальных исследованиях для науки о катализе
- Как катализаторы меняют химическую промышленность, солнечное топливо и переработку полимеров.
- Научные достижения: катализ видит свет
- Научное достижение: ученые наблюдают, как свет разрушает модельный фотокатализатор в режиме, близком к реальному времени
Научные термины могут сбивать с толку. Объяснения DOE предлагают простые объяснения ключевых слов и понятий в фундаментальной науке. В нем также описывается, как эти концепции применяются к работе, которую проводит Управление науки Министерства энергетики, помогая Соединенным Штатам преуспеть в исследованиях по всему научному спектру.
Центральная роль ферментов как биологических катализаторов — клетка
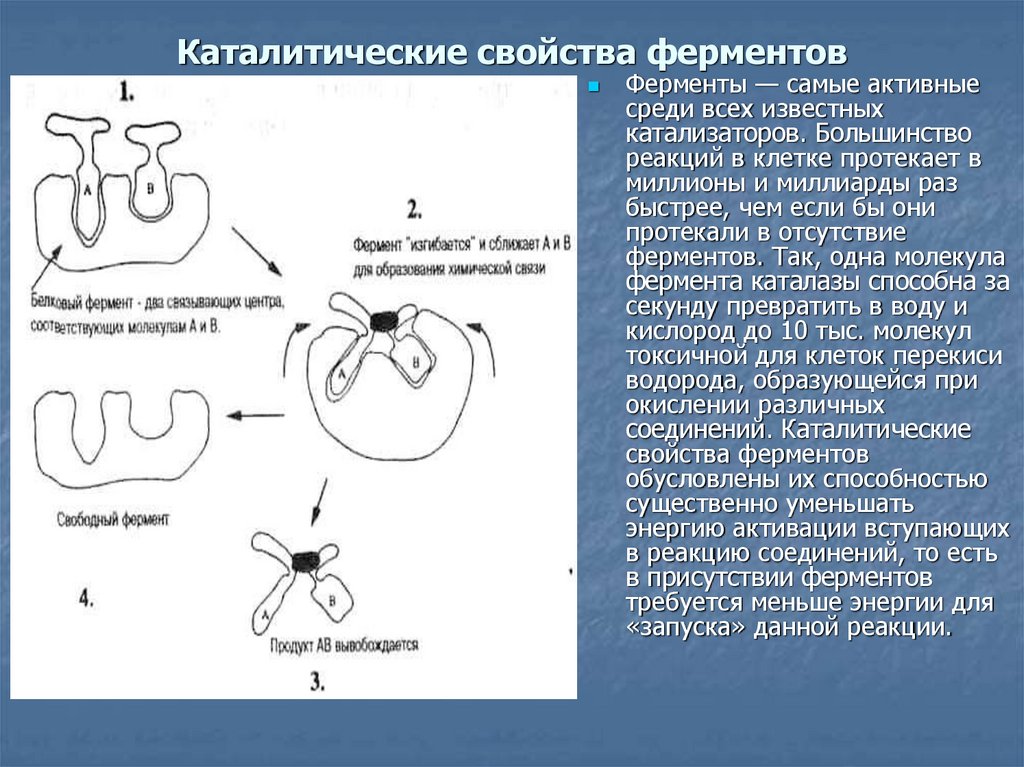
Основная задача белков — действовать как ферменты — катализаторы, которые увеличивают скорость практически всех химических реакций внутри клетки. Хотя РНК способны катализировать некоторые реакции, большинство биологических реакций катализируются белками. В отсутствие ферментативного катализа большинство биохимических реакций протекают настолько медленно, что не могли бы протекать в мягких условиях температуры и давления, совместимых с жизнью. Ферменты ускоряют скорость таких реакций более чем в миллион раз, поэтому реакции, которые без катализа заняли бы годы, могут протекать за доли секунд, если их катализирует соответствующий фермент. Клетки содержат тысячи различных ферментов, и их активность определяет, какие из многих возможных химических реакций действительно происходят внутри клетки.
Каталитическая активность ферментов
Как и все другие катализаторы, ферменты характеризуются двумя фундаментальными свойствами. Во-первых, они увеличивают скорость химических реакций, но сами не поглощаются и не изменяются в результате реакции. Во-вторых, они увеличивают скорость реакции, не нарушая химического равновесия между реагентами и продуктами.
Во-первых, они увеличивают скорость химических реакций, но сами не поглощаются и не изменяются в результате реакции. Во-вторых, они увеличивают скорость реакции, не нарушая химического равновесия между реагентами и продуктами.
Эти принципы ферментативного катализа проиллюстрированы в следующем примере, в котором молекула, на которую действует фермент (называемая субстратом [ S ]) в результате реакции превращается в продукт ( P ). В отсутствие фермента реакция может быть записана следующим образом:
Химическое равновесие между S и P определяется законами термодинамики (как обсуждается далее в следующем разделе этой главы) и представлено отношением скоростей прямой и обратной реакции ( S → P и P → S соответственно). В присутствии соответствующего фермента превращение S по P ускоряется, но равновесие между S и P не меняется. Следовательно, фермент должен одинаково ускорять и прямую, и обратную реакции. Реакцию можно записать следующим образом:
Реакцию можно записать следующим образом:
Обратите внимание, что фермент ( E ) не изменяется в результате реакции, поэтому химическое равновесие остается неизменным, определяемым исключительно термодинамическими свойствами S и P .
Влияние фермента на такую реакцию лучше всего иллюстрируется изменениями энергии, которые должны происходить при превращении 9от 0073 S до P (). Равновесие реакции определяется конечными энергетическими состояниями S и P , на которые не влияет ферментативный катализ. Однако для того, чтобы реакция продолжалась, субстрат должен быть сначала преобразован в более высокое энергетическое состояние, называемое переходным состоянием . Энергия, необходимая для достижения переходного состояния (энергия активации), представляет собой барьер для протекания реакции, ограничивая скорость реакции. Ферменты (и другие катализаторы) действуют, уменьшая энергию активации, тем самым увеличивая скорость реакции. Повышенная скорость одинакова как в прямом, так и в обратном направлении, поскольку оба должны пройти через одно и то же переходное состояние.
Повышенная скорость одинакова как в прямом, так и в обратном направлении, поскольку оба должны пройти через одно и то же переходное состояние.
Рисунок 2.22
Энергетические диаграммы для катализируемых и некаталитических реакций. Проиллюстрированная реакция представляет собой простое превращение субстрата S в продукт P. Поскольку конечное энергетическое состояние P ниже, чем у S , реакция протекает слева направо. Для (подробнее…)
Каталитическая активность ферментов заключается в связывании их субстратов с образованием комплекса фермент-субстрат ( ES ). Субстрат связывается с определенной областью фермента, называемой активным центром. Связанный с активным центром субстрат превращается в продукт реакции, который затем высвобождается из фермента. Таким образом, катализируемая ферментом реакция может быть записана следующим образом:
Обратите внимание, что E не меняется в обеих частях уравнения, поэтому равновесие не изменяется. Однако фермент обеспечивает поверхность, на которой реакции превращения S в P могут происходить более легко. Это результат взаимодействий между ферментом и субстратом, которые снижают энергию активации и способствуют образованию переходного состояния.
Однако фермент обеспечивает поверхность, на которой реакции превращения S в P могут происходить более легко. Это результат взаимодействий между ферментом и субстратом, которые снижают энергию активации и способствуют образованию переходного состояния.
Механизмы ферментативного катализа
Связывание субстрата с активным центром фермента представляет собой очень специфическое взаимодействие. Активные центры представляют собой щели или бороздки на поверхности фермента, обычно состоящие из аминокислот из разных частей полипептидной цепи, объединенных в третичную структуру свернутого белка. Субстраты первоначально связываются с активным центром посредством нековалентных взаимодействий, включая водородные связи, ионные связи и гидрофобные взаимодействия. Как только субстрат связывается с активным центром фермента, несколько механизмов могут ускорить его превращение в продукт реакции.
Хотя в простом примере, рассмотренном в предыдущем разделе, участвовала только одна молекула субстрата, большинство биохимических реакций включают взаимодействие между двумя или более различными субстратами. Например, образование пептидной связи предполагает соединение двух аминокислот. Для таких реакций связывание двух или более субстратов с активным центром в правильном положении и ориентации ускоряет реакцию (1). Фермент обеспечивает матрицу, на которой реагенты собираются вместе и должным образом ориентируются, чтобы способствовать образованию переходного состояния, в котором они взаимодействуют.
Например, образование пептидной связи предполагает соединение двух аминокислот. Для таких реакций связывание двух или более субстратов с активным центром в правильном положении и ориентации ускоряет реакцию (1). Фермент обеспечивает матрицу, на которой реагенты собираются вместе и должным образом ориентируются, чтобы способствовать образованию переходного состояния, в котором они взаимодействуют.
Рисунок 2.23
Ферментативный катализ реакции между двумя субстратами. Фермент обеспечивает матрицу, на которой два субстрата соединяются вместе в правильном положении и ориентации для взаимодействия друг с другом.
Ферменты ускоряют реакции также путем изменения конформации их субстратов, приближая их к конформации переходного состояния. Простейшей моделью взаимодействия фермент-субстрат является модель «замок-ключ» , в которой субстрат точно вписывается в активный центр (). Однако во многих случаях конфигурация как фермента, так и субстрата модифицируется за счет связывания субстрата — процесс, называемый индуцированная посадка . В таких случаях конформация субстрата изменяется так, что она больше напоминает переходное состояние. Напряжение, создаваемое таким искажением подложки, может дополнительно способствовать ее переходу в переходное состояние за счет ослабления критических связей. Более того, переходное состояние стабилизируется его прочным связыванием с ферментом, что снижает необходимую энергию активации.
В таких случаях конформация субстрата изменяется так, что она больше напоминает переходное состояние. Напряжение, создаваемое таким искажением подложки, может дополнительно способствовать ее переходу в переходное состояние за счет ослабления критических связей. Более того, переходное состояние стабилизируется его прочным связыванием с ферментом, что снижает необходимую энергию активации.
Рисунок 2.24
Модели фермент-субстратного взаимодействия. (A) В модели «замок-ключ» субстрат точно соответствует активному центру фермента. (B) В модели индуцированного соответствия связывание субстрата искажает конформации как субстрата, так и фермента. Это искажение (далее…)
В дополнение к объединению нескольких субстратов и искажению конформации субстратов для приближения к переходному состоянию многие ферменты непосредственно участвуют в каталитическом процессе. В таких случаях специфические боковые цепи аминокислот в активном центре могут реагировать с субстратом и образовывать связи с промежуточными продуктами реакции. Кислотные и основные аминокислоты часто участвуют в этих каталитических механизмах, как показано в последующем обсуждении химотрипсина как примера ферментативного катализа.
Кислотные и основные аминокислоты часто участвуют в этих каталитических механизмах, как показано в последующем обсуждении химотрипсина как примера ферментативного катализа.
Химотрипсин является членом семейства ферментов (сериновых протеаз), которые расщепляют белки, катализируя гидролиз пептидных связей. Реакция может быть записана следующим образом:
Различные представители семейства сериновых протеаз (включая химотрипсин, трипсин, эластазу и тромбин) обладают различной субстратной специфичностью; они преимущественно расщепляют пептидные связи, расположенные рядом с разными аминокислотами. Например, в то время как химотрипсин расщепляет связи рядом с гидрофобными аминокислотами, такими как триптофан и фенилаланин, трипсин расщепляет связи рядом с основными аминокислотами, такими как лизин и аргинин. Однако все сериновые протеазы сходны по структуре и используют один и тот же механизм катализа. Активные центры этих ферментов содержат три критически важные аминокислоты — серин, гистидин и аспартат, — которые управляют гидролизом пептидной связи. Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли остатка серина.
Действительно, эти ферменты называются сериновыми протеазами из-за центральной роли остатка серина.
Субстраты связываются с сериновыми протеазами путем встраивания аминокислоты рядом с сайтом расщепления в карман в активном центре фермента (). Природа этого кармана определяет субстратную специфичность различных членов семейства сериновых протеаз. Например, связывающий карман химотрипсина содержит гидрофобные аминокислоты, которые взаимодействуют с гидрофобными боковыми цепями его предпочтительных субстратов. Напротив, связывающий карман трипсина содержит отрицательно заряженную кислую аминокислоту (аспартат), которая способна образовывать ионную связь с остатками лизина или аргинина своих субстратов.
Рисунок 2.25
Связывание субстрата сериновыми протеазами. Аминокислота, примыкающая к расщепляемой пептидной связи, вставляется в карман в активном центре фермента. У химотрипсина карман связывает гидрофобные аминокислоты; связывающий карман трипсина содержит (подробнее. ..)
..)
Связывание субстрата позиционирует расщепляемую пептидную связь рядом с активным центром серина (). Затем протон этого серина переносится в активный центр гистидина. Конформация активного центра способствует переносу протона, поскольку гистидин взаимодействует с отрицательно заряженным аспартатным остатком. Серин реагирует с субстратом, образуя тетраэдрическое переходное состояние. Затем пептидная связь расщепляется, и С-концевая часть субстрата высвобождается из фермента. Однако N-концевой пептид остается связанным с серином. Эта ситуация разрешается, когда молекула воды (второй субстрат) входит в активный центр и обращает предшествующие реакции. Протон молекулы воды переносится на гистидин, а его гидроксильная группа – на пептид, образуя второе тетраэдрическое переходное состояние. Затем протон переносится с гистидина обратно на серин, а пептид высвобождается из фермента, завершая реакцию.
Рисунок 2.26
Каталитический механизм химотрипсина. Три аминокислоты в активном центре (Ser-195, His-57 и Asp-102) играют решающую роль в катализе.
Этот пример иллюстрирует некоторые особенности ферментативного катализа; специфичность фермент-субстратных взаимодействий, расположение различных молекул субстрата в активном центре и участие остатков активного центра в формировании и стабилизации переходного состояния. Хотя тысячи ферментов в клетках катализируют множество различных типов химических реакций, в их работе применяются одни и те же основные принципы.
Коэнзимы
Помимо связывания своих субстратов, активные центры многих ферментов связывают другие малые молекулы, участвующие в катализе. Простетические группы представляют собой небольшие молекулы, связанные с белками, в которых они играют важную функциональную роль. Например, кислород, переносимый миоглобином и гемоглобином, связан с гемом, простетической группой этих белков. Во многих случаях ионы металлов (например, цинка или железа) связаны с ферментами и играют центральную роль в каталитическом процессе. Кроме того, различные низкомолекулярные органические молекулы участвуют в специфических типах ферментативных реакций. Эти молекулы называются коферментами, потому что они работают вместе с ферментами, увеличивая скорость реакции. В отличие от субстратов коферменты не изменяются необратимо в результате реакций, в которых они участвуют. Скорее, они перерабатываются и могут участвовать во множестве ферментативных реакций.
Эти молекулы называются коферментами, потому что они работают вместе с ферментами, увеличивая скорость реакции. В отличие от субстратов коферменты не изменяются необратимо в результате реакций, в которых они участвуют. Скорее, они перерабатываются и могут участвовать во множестве ферментативных реакций.
Коэнзимы служат переносчиками нескольких типов химических групп. Ярким примером кофермента является никотинамидадениндинуклеотид ( НАД + ), который функционирует как переносчик электронов в окислительно-восстановительных реакциях (). НАД + может принять ион водорода (Н + ) и два электрона (е — ) с одного субстрата, образуя НАДН. Затем NADH может отдать эти электроны второму субстрату, вновь образуя NAD + . Таким образом, НАД + переносит электроны с первого субстрата (который окисляется) на второй (который восстанавливается).
Рисунок 2.27
Роль НАД + в окислительно-восстановительных реакциях. (A) Никотинамидадениндинуклеотид (НАД + ) действует как переносчик электронов в окислительно-восстановительных реакциях, принимая электроны (е — ) с образованием НАДН. (B) Например, NAD + может принимать электроны от одного субстрата (подробнее…)
(A) Никотинамидадениндинуклеотид (НАД + ) действует как переносчик электронов в окислительно-восстановительных реакциях, принимая электроны (е — ) с образованием НАДН. (B) Например, NAD + может принимать электроны от одного субстрата (подробнее…)
Несколько других коферментов также действуют как переносчики электронов, а третьи участвуют в переносе различных дополнительных химических групп (например, , карбоксильные группы и ацильные группы; ). Одни и те же коферменты действуют вместе с множеством различных ферментов, катализируя перенос определенных химических групп между широким спектром субстратов. Многие коферменты тесно связаны с витаминами, которые частично или полностью составляют структуру кофермента. Витамины не требуются бактериям, таким как E. coli , но являются необходимыми компонентами рациона человека и других высших животных, утративших способность синтезировать эти соединения.
Таблица 2.1
Примеры коферментов и витаминов.
Регулирование активности ферментов
Важной особенностью большинства ферментов является то, что их активность не постоянна, а может модулироваться. То есть активность ферментов можно регулировать так, чтобы они функционировали надлежащим образом для удовлетворения различных физиологических потребностей, которые могут возникнуть в течение жизни клетки.
Одним из распространенных типов регуляции ферментов является ингибирование по принципу обратной связи, при котором продукт метаболического пути ингибирует активность фермента, участвующего в его синтезе. Например, аминокислота изолейцин синтезируется серией реакций, начиная с аминокислоты треонина (). Первый этап пути катализируется ферментом треониндезаминазой, которая ингибируется изолейцином, конечным продуктом пути. Таким образом, достаточное количество изолейцина в клетке ингибирует треониндезаминазу, блокируя дальнейший синтез изолейцина. Если концентрация изолейцина снижается, ингибирование по принципу обратной связи снимается, треониндезаминаза больше не ингибируется и синтезируется дополнительный изолейцин. Регулируя таким образом активность треониндезаминазы, клетка синтезирует необходимое количество изолейцина, но избегает затрат энергии на синтез большего количества изолейцина, чем необходимо.
Регулируя таким образом активность треониндезаминазы, клетка синтезирует необходимое количество изолейцина, но избегает затрат энергии на синтез большего количества изолейцина, чем необходимо.
Рисунок 2.28
Запрет обратной связи. Первый этап превращения треонина в изолейцин катализируется ферментом треониндезаминазой. Активность этого фермента ингибируется изолейцином, конечным продуктом пути.
Ингибирование по принципу обратной связи является одним из примеров аллостерической регуляции, при которой активность фермента контролируется путем связывания небольших молекул с регуляторными участками фермента (). Термин «аллостерическая регуляция» происходит от того факта, что регуляторные молекулы связываются не с каталитическим участком, а с отдельным участком на белке (9).0073 алло = «другое» и steric = «сайт»). Связывание регуляторной молекулы изменяет конформацию белка, что, в свою очередь, изменяет форму активного центра и каталитическую активность фермента. В случае треониндезаминазы связывание регуляторной молекулы (изолейцина) ингибирует ферментативную активность. В других случаях регуляторные молекулы служат активаторами, стимулируя, а не ингибируя ферменты-мишени.
В случае треониндезаминазы связывание регуляторной молекулы (изолейцина) ингибирует ферментативную активность. В других случаях регуляторные молекулы служат активаторами, стимулируя, а не ингибируя ферменты-мишени.
Рисунок 2.29
Аллостерическая регуляция. В этом примере активность фермента ингибируется связыванием регуляторной молекулы с аллостерическим сайтом. В отсутствие ингибитора субстрат связывается с активным центром фермента, и реакция протекает. Переплет (далее…)
Активность ферментов можно также регулировать путем их взаимодействия с другими белками и ковалентными модификациями, такими как добавление фосфатных групп к остаткам серина, треонина или тирозина. Фосфорилирование является особенно распространенным механизмом регуляции активности ферментов; добавление фосфатных групп либо стимулирует, либо ингибирует активность многих различных ферментов (). Например, мышечные клетки реагируют на эпинефрин (адреналин), расщепляя гликоген на глюкозу, тем самым обеспечивая источник энергии для повышения мышечной активности.
